8.3 万例死亡、170 万例受伤事件后,FDA 决定整改医疗器械审批
阴道网片毁了众多女性的生活;金属髋关节导致钴中毒;机器人手术后肠管掉到体外;乳房填充物与罕见癌症有关……
不知道大家对于这些由于医疗器械导致的伤害事件是否还有印象。
我们曾经发表过相关文章,素材来源于 Netflix 出品的纪录片《尖端医疗的真相》。
在影片的后段,由于植入不安全节育器(Essure)而失去正常生活的女性们自发组织起来,向 FDA 提出抗议。
截止当时,FDA 并没有给出让人满意的说法和解决方案,时至今日,终于迎来了转机。
11 月 26 日,美联社发布新闻「FDA 将对医疗器械审批程序进行全面整改」。

图源:美联社
这意味着,通过对即将上市的医疗器械进行全新的审批程序,由于医疗器械安全问题所带来的伤害事件将有望降低。
伤害有多远?
为了理解这一改革的意义,首先要知道医疗器械的伤害离我们究竟有多远。
请看一组数据:据 FDA 报告,在过去的 10 年里,医疗器械造成了约 170 多万起伤害事件,近 83,000 起死亡事件与医疗器械相关。
纪录片《尖端医疗的真相》中, angle 在医生的建议下采用了当时最新的节育产品——Essure。
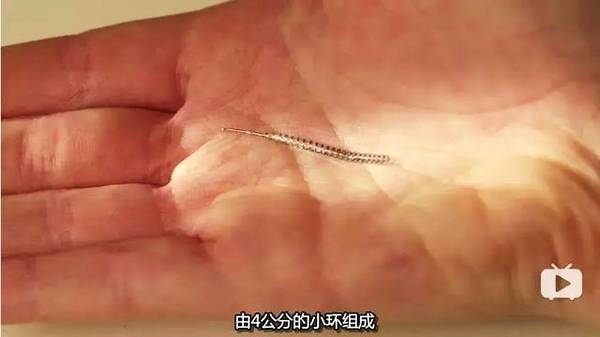
图源:《尖端医疗的真相》
通过植入输卵管引发局部炎症反应而阻塞输卵管的 Essure ,是一种宣称「安全、便捷、节育率高达 99%」的产品。但它却给 angle 今后的日子带去了无尽的痛苦。

图源:《尖端医疗的真相》
Essure 使她饱受自体免疫反应的困扰,为了移除 Essure,她不得不进行子宫摘除术(植入设备残留)、两次阴道残端修补术(阴道残端愈合不良)、以及三次关节手术(自体免疫反应)。

图源:《尖端医疗的真相》
最后, angle 绝望地说「Essure 毁了我的一生!」
对此,器械公司的解释是,「少数女性会有自体免疫反应。」但在 angle 看来,这绝对不是少数,因为仅 angle 所在的「Essuer 自体免疫组织」里,就有 33,000 名受害成员。
值得注意的是,当受伤的女性聚集在 ACOG(美国妇产科医师学会)年度会议举办地,向参会的医生们讲解自己被 Essure 伤害的遭遇时,大多数医生不愿意相信她们的话,医生们普遍觉得:这是手术的并发症,没有一种医疗手段能完全避免并发症。

图源:《尖端医疗的真相》
诚然,有些医生可能会因为某些无法言说的原因而掩盖事实,但大多数医生确实不清楚真相。
甚至,身为护士的 gaby 自身也是 Essure 的受害者之一。
骨科医生 tower 也因植入钴金属髋关节而出现手颤抖,耳鸣、经常重复自己的话等神经症状。他自己也是事后才知道,含有钴金属的假体会因磨损而扩散,引发患者钴元素中毒,继而出现神经问题。

重置关节假体时,医生发现 tower 的关节置换处已磨损至此
图源:《尖端医疗的真相》
直面患者的专业医生都被蒙在鼓里,患者又从哪里获得专业的建议呢?由此可见,医疗器械一旦上市,大多数患者几乎是毫不犹豫地选择信任和接受。
而信任背后却蛰伏着危险,据调查:
全球有超过 10 万名女性对可造成持续疼痛的阴道植入网片(治疗尿失禁的植入设备)提起诉讼;
超过 50 万个可造成钴中毒的金属髋关节被植入患者体内;
约有 350,000 台存在问题的植入式除颤器被使用
……
若不进行改革,这样的数据只会不断刷新。
审批存在哪些问题?
鲜活的例子、触目惊心的数据无一不在叩击医者的内心,那么问题究竟出在哪里?
诚然,这是一条复杂的利益链,足以牵一发而动全身,而其中最值得一提的因素,也是 FDA 此次整改的重点,那就是医疗器械审批流程。
大多数人以为,医疗器械一定是经过多次临床试验被证明安全有效后才被批准入市的,而事实上却并非如此。
FDA 医疗器械审批采用两种流程,一种是上市前审批流程(PMA),这种类似于新药上市的流程,要求制造商提供足够的临床试验数据,由 FDA 认定其安全性之后才会被批准上市。
第二种流程就是广为诟病的 510(k)流程,由于器械公司抱怨每年器械都在更新,而每种新器械都做大量的临床试验费时费力,于是 510(k)流程诞生了。
在这个系统下,新器械只需要证明与已经上市的器械有相似的原理即可以被批准上市,即使「前基设备(predicate device)」已经存在问题。
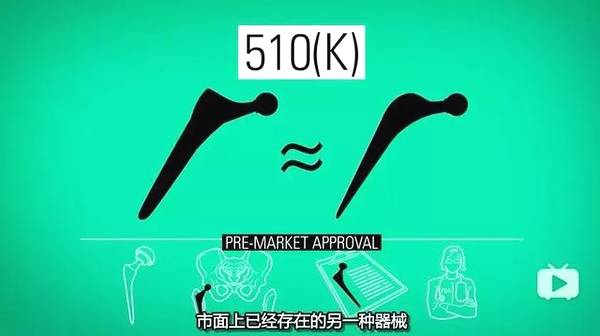
图源:《尖端医疗的真相》
遗憾的是,大多数的新器械都采用 510(k)系统,因此,大量未经严格试验的新器械就这样走向了市场。
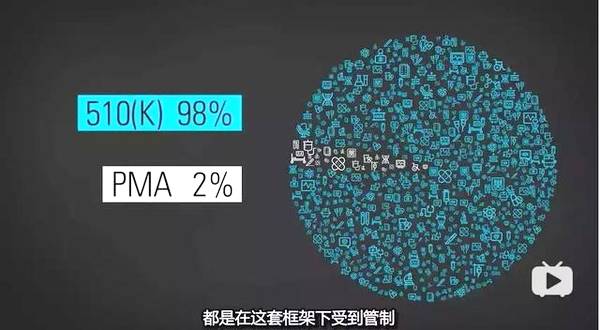
图源:《尖端医疗的真相》
甚至,纪录片还展示了一段 FDA 审批 Essure 时的真实录像。录像中,持有公司股份的临床试验首席研究员对试验结果进行汇报,专家组提出了很多问题:
如果触碰到电极会怎么样? 会不会造成输卵管穿孔? 金属过敏的人植入会怎样?
尽管这些问题都没有得到解答,但这个样本量少,跟踪时间短的试验还是被官员们认可,并批准其上市。
在会议的结尾,一位专家组成员问:「如果十年后出现了问题怎么办?」
另一名成员用玩笑的语气回答:「那时候私家侦探会质问我们在场的每一个人,为什么当时要通过审批?」
说完,全场哄笑。
十年后,当深受其害的 angle 看到 Essure 当年竟是如此戏谑地通过了审批,心中的愤怒之火燃烧得更旺了。她表示:「如果所有的医疗器械都是这样审批通过的,那这个国家也很危险了。」
骨科医生 tower 移除了钴金属关节假体后,症状都神奇的消失了。tower 知道,这种假体可能有重大隐患,他多次提醒当局展开调查均无果。于是,他只能针对自己的患者(已经接受过置换)进行相关的研究,并将得出的结果上报给当局。
然而,他表示:「我觉得这种研究不该由我来做。」

图源:《尖端医疗的真相》
改革遭遇了哪些阻力?
纪录片对医疗器械领域各种乱象的揭露为改革埋下了伏笔。
能取得今天阶段性的胜利,还得归功于 50 多家与国际调查记者协会(ICIJ)合作的媒体,250 多位记者和数据专家共同组成了这个调查小组。
在调查期间,他们分析了数百万医疗器械的数据记录,召回存在严重健康隐患的产品,对可能存在隐患的产品进行警告。
在这一场硬仗中,调查小组所面临的阻碍是巨大的。以利益为目标的器械公司用金钱左右了太多东西。
医疗器械公司常用的手法之一是派出强大的游说军团,宣传新器械的安全性有效性(即使没有做过研究),宣扬「为患者着想」的初衷。
他们利用强大的游说影响力对监管机构施压,没有医疗背景的政客容易被他们的言论左右,导致审批标准逐年下降。
据披露:某器械公司及其会员公司 2017 年游说花费超过 6,400 万美元。
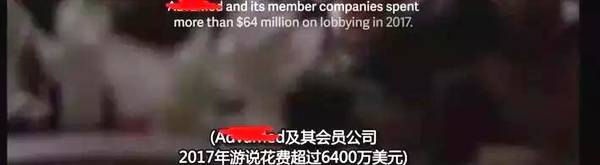
图源:《尖端医疗的真相》
除此之外,根据 ICIJ 对美国司法部和证券交易委员会数据的审查,制造商自 2008 年以来至少支付了 16 亿美元,以解决与美国和其他国家监管机构的腐败,欺诈和其他违规行为的指控。
更具杀伤力的是,不少 FDA 官员离任后直接加入了器械行业。

图源:《尖端医疗的真相》
这些现象背后潜藏的危机可想而知,而环环相扣的利益集团更是使得调查重重受阻。
数据库的意义何在?
调查小组所披露的事实令人惊讶,取得的成绩也令人欣慰,除了推动改革,数据库的建立也是其中最为关键的一步。
在全球范围内,大部分的国家和地区的卫生当局接收不到真实完整的安全事故信息。
例如 FDA 的上报系统是一个自愿的上报系统,发现不良反应的医生没有上报的义务,而有义务的器械公司却并不想上报。据估计,只有 2% ~4% 的不良事故被上报,而且事故越严重,越不容易被上报。
因此,当一种器械的安全性被质疑时,往往已经有成千上万的人使用了该器械。
就算某种器械可能存在问题,卫生当局一般也拒绝透露对公众造成伤害的有关信息。
当确定某些医疗器械出现问题时,这些消息也不会向医生公布,更不用说患者了,这导致某些设备在一些国家被召回,而在另外的国家却被允许使用。
例如 Essure 在欧洲已经被召回,却仍然被允许存在于美国市场。还有一些本可以通过移除植入设备消除症状的「疾病」被误诊。
数据库的建立弥补了这些缺失。
在为期一年的调查期间,国际调查记着联合会(ICIJ)和 36 个国家的 58 家媒体机构合作编制了国际医疗器械数据库(IMDD)填补了医疗器械安全信息的空白。
该数据库包含了全球范围内 70,000 多个医疗器械召回、安全警告等信息。任何人都可以在网站上(https://medicaldevices.icij.org/)搜索关于某种医疗器械的安全历史。

图源:https://medicaldevices.icij.org/
看到这里,在为调查小组取得的成绩点赞的同时,身为医务人员的你,是否思考过这样一个问题:「最新真的意味着最好吗?」
最后,套用骨科医生 tower 的一句话,相信会对大家有所启发:
「身为医生的我们,似乎不要求很高级别的证据就愿意植入某种新器械,但如果要放弃这种器械,我们便要求看到强大的证据。这是本末倒置。」
完全依赖某个权威机构已成为过去式,当面对新技术、新器械时,医生们还需要多问一句「对患者来说,安全吗?」
信息来源:丁香园
联系方式
地址:中国(上海)自由贸易试验区 外高桥美约路222号五楼501室
邮 编:200131
传 真:58661522
电 话:58661516
邮 箱:mdta@mdta.org.cn
下载专区
相关链接
©2018 上海浦东医疗器械贸易行业协会
沪ICP备19039930号-1 沪公网安备31019002000210号 互联网药品信息服务资格证书编号:(沪)-非经营性-2022-0001
技术支持:维程教育




 loading......
loading......