国家药监局发布2018年政府信息公开工作年度报告
国家药品监督管理局2018年政府信息公开工作年度报告日前正式发布。报告内容包括概况、主动公开政府信息情况、依申请公开和不予公开政府信息情况、信息公开收费及减免情况、因信息公开申请行政复议或提起行政诉讼情况、信息公开工作存在的主要问题和改进措施等,数据统计期限为2018年1月1日至2018年12月31日。该报告根据《中华人民共和国政府信息公开条例》的有关规定编制,全文如下:
一、概况
2018年,国家药品监督管理局认真贯彻落实党的十九大和十九届二中、三中全会精神,以习近平新时代中国特色社会主义思想为指导,高度重视政府信息公开工作,坚持统筹兼顾、突出重点,大力推进决策、执行、管理、服务、结果公开,按照《中华人民共和国政府信息公开条例》《国务院办公厅关于印发2018年政务公开工作要点的通知》(国办发〔2018〕23号),坚持稳中求进工作总基调,创新监管方式,进一步强化制度建设,加大重点领域主动公开力度,积极做好政策解读和舆论引导,及时回应社会关切,不断加大信息公开力度,提高监管工作透明度。
二、主动公开政府信息情况
(一)加强信息公开制度建设。制定发布《国家药品监督管理局2018年政务公开工作实施方案》《国家药品监督管理局政府网站信息发布管理办法(暂行)》等相关制度文件,同步更新信息公开指南,明确药品监管信息公开工作思路、要求,建立健全信息公开制度规范,不断提升药品监管信息公开工作的质量和实效。
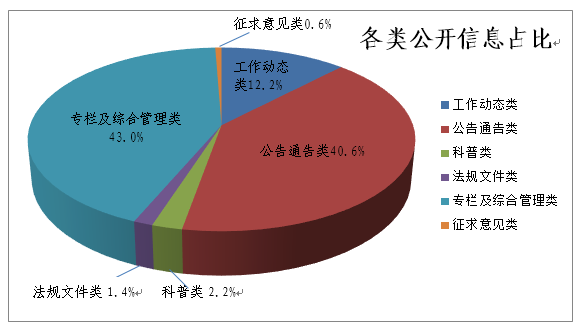
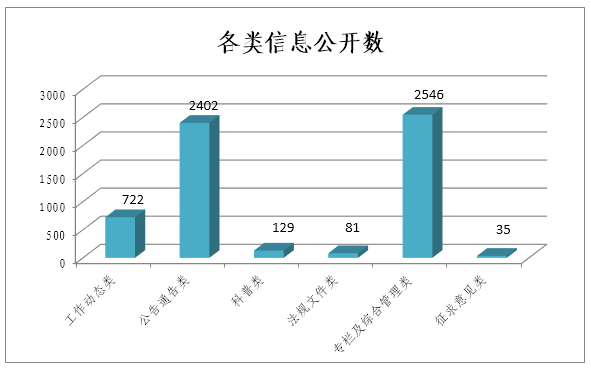
(二)加强网站信息主动公开力度。2018年,国家药监局网站主动公开政府信息5915条。其中:工作动态类信息722条,占12.2%;公告通告类信息2402条,占40.6%;科普类信息129条,占2.2%;法规文件类信息81条,占1.4%;专栏及综合管理类信息2546条,占43.0%;征求意见类信息35条,占0.6%。网站已建立80余个信息发布栏目、4个互动栏目,1个行政许可服务子站。在清华大学“2018年中国政府网站绩效评估报告”中,国家药监局网站名列部委政府网站第5名。
信息来源:国家药品监督管理局
(三)加强重点领域信息公开。
1、药品医疗器械审评审批信息公开。为便于行政相对人及时了解审评审批进度,依托药审中心网站提供查询申报药品的审评审批进度信息渠道。为保障公众用药安全,2018年,批准上市新药48个,经国家局批准的药品审批信息均可在局政府网站数据库中供公众查询。上线运行上市药品目录集系统,2018年度共收录424个品规。按月发布批准上市医疗器械产品公告。确定99项医疗器械行业标准制修订项目,审核发布医疗器械行业标准104项。起草医疗器械唯一标识系统规则,按程序在原食品药品监管总局、市场监管总局和中国政府法制信息网对外公开征求意见,并进行了WTO/TBT通报。发布62项医疗器械技术审查指导原则。
2、药品监督检查和抽检信息公开。组织开展药品生产企业跟踪和飞行检查,针对检查发现不符合GMP的企业,对外发布跟踪检查通报22份、发布飞行检查通报4份、通告8份,对安徽广印堂中药股份有限公司、长春长生生物科技有限责任公司等企业涉嫌违法违规行为进行信息公开。制定实施药品经营企业年度检查计划,对严重违反药品经营质量管理规范的16家企业依法查处并公开曝光。2018年7月23日—8月9日,对全国现有45家疫苗生产企业开展彻底的风险排查。2018年全年发布国家药品抽检通告26个,对518批次不合格药品及相关企业和单位予以公示,对检出的不合格产品,有关药品监督管理部门已责令相关企业立即采取风险控制措施,并依法予以查处。发布了药品不良反应年度报告。2018年,根据分析评价结果,全年共发布12期药物警戒快讯,涉及国外药品安全信息59条;发布3期药品撤市公告,停止了4个药品的生产、销售和使用,修订了33个品种的药品说明书。制定发布《国家药监局关于印发药品出口销售证明管理规定的通知》,为我国药品出口提供便利和服务;制定发布《药品医疗器械境外检查管理规定的公告》《关于药品上市许可持有人直接报告不良反应事宜的公告》《国家药监局关于加强药品集中采购和使用试点期间药品监管工作的通知》,落实党中央、国务院关于国家药品集中采购和使用试点工作的重要决策部署;发布《国家药监局关于药品信息化追溯体系建设指导意见》,推动构建全品种全过程药品追溯体系。继续推进出口欧盟原料药证明文件的信息公开,在为出口企业提供服务的同时,以信息共享的方式实现了境外监管机构的协作。2018年在“出口欧盟原料药证明文件信息查询系统”中,公布了93条新增的证明文件信息。
3、化妆品监督检查和抽检信息公开。一是2018年对51家化妆品生产经营企业开展飞行检查,及时在局网站上发布检查中发现的问题,并对其中12家严重违反生产许可工作规范的生产企业进行通告,责令暂停生产,提高监管效能和公正性。二是在2018年国家级化妆品监督抽检中,已发布不合格产品通告19期,共曝光了153批次不合格防晒类产品,43批次不合格面膜类产品,7批次不合格祛痘/抗粉刺类产品,363批次不合格染发类产品,并要求各地监管部门对不合格产品的生产经营企业进行核查处置,及时对外公布处罚结果。三是指导省局对有关已办结的重大化妆品案件查处结果向社会公开,提高对违法行为的震慑力。在我局政府网站主动公开全国各省备案的国产非特殊用途化妆品产品信息,包括产品的名称、全成分、销售包装以及监督检查情况等项目,目前备案产品130余万个;主动公开国家局审批的特殊用途化妆品和进口化妆品的批件信息,包括产品名称、企业名称和地址、产品类别、批准文号和有效期限、产品技术要求等项目,目前有效批件信息约8万条;主动公开全国的化妆品生产企业信息,包括企业的名称、生产许可证编号、地址、法人等项目,目前共有4699家企业的基本信息。针对市场上一款可能造成儿童误饮误食的护肤水、日常使用中易引起不良反应的染发类化妆品等发布消费者警示信息,提醒消费者关注化妆品使用安全,引导理性消费。
4、医疗器械监督检查和抽检信息公开。2018年共对94家国内生产企业开展飞行检查,对其中存在严重缺陷的21家企业责令停产整改,所有检查情况和21家企业的停产通告均在国家局官方网站公开发布。2018年1月9日发布《关于洛阳市美好人生医疗器械有限公司等4家医疗器械经营企业停业整顿的通告》(2018年第11号)。2018年,在国家局网站医疗器械召回专栏发布召回信息134个,其中一级召回9个(仅在境外实施医疗器械召回的1个),仅在境外实施医疗器械二、三级召回125个。各省局发布的召回信息链接在国家局网站499个。国家局网站共计公开召回信息633个,有效消除医疗器械安全隐患,保证医疗器械的安全。2018年11月23日在国家局官网发布《关于个人购买使用医疗器械的提示》。在国家局网站及时发布国家医疗器械监督抽检结果,2018年,发布国家医疗器械监督抽检公告2期、通告9期。同时加快2018年抽检结果发布,实现当年检、当年公布。
5、做好部门预决算及“三公”经费公开工作。根据财政部统一要求,认真编制原食品药品监管总局2018年部门预算和2017年部门决算公开文稿。因机构改革原因,原食品药品监管总局并入市场监管总局,故将编制的原食品药品监管总局2018年预算公开文稿报送市场监管总局,由其于2018年4月在其官网公开,公开内容包括2018年部门预算、“三公”经费预算、机关运行经费、政府采购、国有资产占有使用、绩效目标设置等情况信息。在公开的原食品药品监管总局2018年部门预算中,首次公开了“食品安全监管”重点一级项目文本。2018年7月,在原食品药品监管总局网站公开了原食品药品监管总局2017年部门决算报表及情况说明,同时公开了2017年“三公”经费支出、机关运行经费支出、政府采购支出、国有资产占有、预算绩效管理工作开展、项目绩效自评结果等情况信息。
(四)稳步推进两会建议提案复文公开。2018年我局继续稳步推进两会建议提案复文公开工作,一是加强对建议提案复文公开的审核把关。对主办、独办、分办的建议提案复文,涉及公共利益、公众权益、社会关切及需要社会广泛知晓的,应公开尽公开。2018年,在局政府网站主动公开建议提案复文56件,其中建议复文31件,提案复文25件。二是加强对办理结果公开工作的跟踪督查。专门印发通知,督促建议提案复文按程序、时限公开,确保公开工作规范、有序。三是主动公开2017年总体办理情况接受社会监督。通过报刊专栏、新媒体等途径,主动公开建议和提案办理总体情况,方便公众知晓,回应社会关切。
(五)积极做好政策信息的解读和回应。一是围绕上市药品目录集、仿制药一致性评价、HPV疫苗审评审批等重点工作组织开展各类新闻发布活动,展现监管部门工作成效,及时传递权威声音,引导公众科学认知药品监管工作。2018年共组织新闻发布会(含通气会、见面会等)8次,国家局政府网站(含原食药总局网站、过渡期网站)发布信息1.3万余条。二是积极开展媒体合作,主动组织新闻发布。2018年多次组织媒体开展专访工作,带领媒体走进药审中心、器审中心、核查中心,深入了解报道药品医疗器械审评审批改革工作。2018年全年办理人民日报、新华社、南方都市报等媒体采访函百余件,并协调有关司局接受纽约时报北京分社、彭博社等境外媒体采访,宣传我国药品安全领域改革发展成效,对国际社会了解、认可我国药品监管工作起到了积极作用。三是持续开展科普宣传,提升公众科学素养。连续第11年开展以“安全用药,共享健康”为主题的“全国安全用药月”科普活动,积极宣传改革开放40周年以来药品医疗器械安全领域取得的丰硕成果,增进公众对我国药品安全监管工作的认知和理解。针对不同群体、各自用药需求及存在的认知误区,借助现代传媒和手段,分众化、差异化地宣传安全用药理念和使用知识。据统计,安全用药月活动期间,共开展安全用药科普宣教活动11777场次,发放宣传资料1358.6万份,通过媒体传播有效覆盖受众。四是及时回应社会关切。加强舆情监测,梳理分析舆论关注点,针对公众关注的药品安全相关热点问题,以新闻发言人答记者问、开展媒体一对一专访等形式发布信息,及时回应公众关切,传递正面、权威的监管工作信息。
(六)健全发布平台,完善新媒体运营维护。一是开展国家局网站平台建设工作。完成药监局过渡期网站建设,确保过渡期网站在挂牌当日同步上线,稳定运行。同时落实国家局正式网站设计、开发、上线工作,国家局网站已于2018年11月3日正式上线,运行情况良好。二是加强新媒体新闻发布能力。积极与微信、微博管理部门沟通,协调开通药监局微信公众号和头条号“中国药闻”、政务微博“中国药品监管”等新媒体平台,实现与国家局网站同步上线,在“两微一端”信息发布平台搭建和运维上先行一步。2018年,微信公众号“中国药闻”共发布文章1547篇,文章总阅读数近580万余人次;政务微博“中国药品监管”共推送文章1437篇,文章总阅读数达到6806万余人次。
三、依申请公开和不予公开政府信息情况
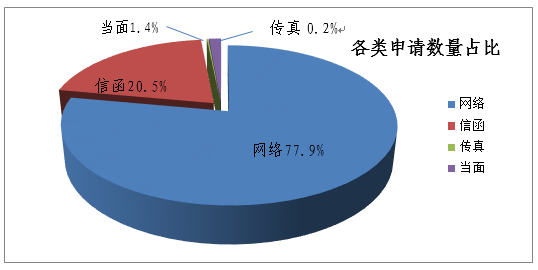
(一)申请情况。2018年,共收到有效依申请公开事项924件,其中:通过在线平台、电子邮件等网络形式申请720件,占77.9%;以信函形式申请189件,占20.5%;以传真形式申请2件,占0.2%;当面递交申请13件,占1.4%。
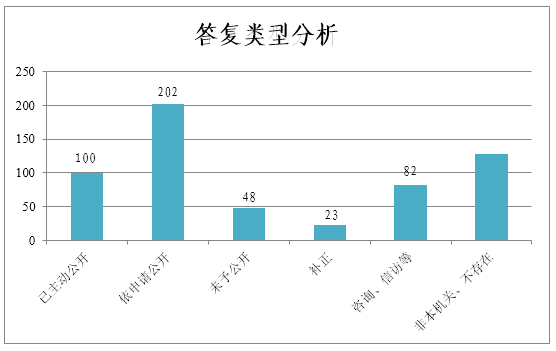
(二)回复情况。924件依申请公开申请事项中,电话办结51件,申请人撤销52件,办理中8件(均在征求企业意见)。其余813件均已在法定时限内予以回复,共出具书面答复583件(部分同一申请人的相关申请事项合并答复)。在全部583件回复中,属已主动公开的100件,占17.2%;依申请予以公开的202件,占34.6%;因“涉及商业秘密”等情况未予公开的48件,占8.2%;告知申请人予以补正23件,占3.9%;告知通过咨询、信访等其他途径办理82件,占14.1%;“非本机关政府信息”“信息不存在”等其他情形128件,占22.0%。
四、信息公开收费情况
2018年,我局在办理依申请公开工作中,未向申请人收取费用。
五、行政复议和行政诉讼情况
2018年,我局因政府信息公开而被提起行政复议8件,一审行政诉讼9件。8件行政复议案件中,2件由申请人主动撤回, 2件作出不予受理决定,4件作出维持国家局行政行为的复议决定;9件行政诉讼案件中,6件法院裁定驳回原告起诉,2件法院裁定准予原告撤诉,1件法院判决驳回原告诉讼请求。
六、存在的主要问题和改进措施
在推进政府信息公开中,存在的主要问题和困难是:主动公开内容深度和广度还可以进一步完善,信息公开的工作机制和工作水平还需进一步提升。2019年,我局将认真贯彻党的十九大精神,严格按照《中华人民共和国政府信息公开条例》和国务院有关要求,进一步加大全系统监管信息的公开力度,进一步加强平台建设,进一步提高工作能力,重点做好以下工作:
(一)加强主动公开力度。持续推进主动公开,在梳理本部门应当公开内容的基础上,积极研究更新主动公开目录,优化网站栏目设置,强化对重要政策、重大突发事件、热点问题等相关信息的及时发布、权威解读。
(二)加强公开平台建设。加强国家局网站建设,加强新技术应用,完善服务功能,进一步提升网站服务能力与水平。强化国家局网站信息发布“第一平台”作用,进一步拓宽信息公开渠道,发挥新媒体及第三方平台作用,进一步提高工作透明度,增强群众获取信息的便捷性。
(三)加强干部队伍能力建设。加强有关法律法规的宣传学习,抓实抓细业务交流与培训工作,大力提升国家局各司局主动公开意识,增强政府信息公开工作能力。继续加强依申请公开工作中登记、转办、办理、审核等环节的规范化管理,发挥法律顾问专家外脑作用,加强对疑难问题的讨论研究,切实提升依申请公开工作服务水平。
联系方式
地址:中国(上海)自由贸易试验区 外高桥美约路222号五楼501室
邮 编:200131
传 真:58661522
电 话:58661516
邮 箱:mdta@mdta.org.cn
下载专区
相关链接
©2018 上海浦东医疗器械贸易行业协会
沪ICP备19039930号-1 沪公网安备31019002000210号 互联网药品信息服务资格证书编号:(沪)-非经营性-2022-0001
技术支持:维程教育




 loading......
loading......