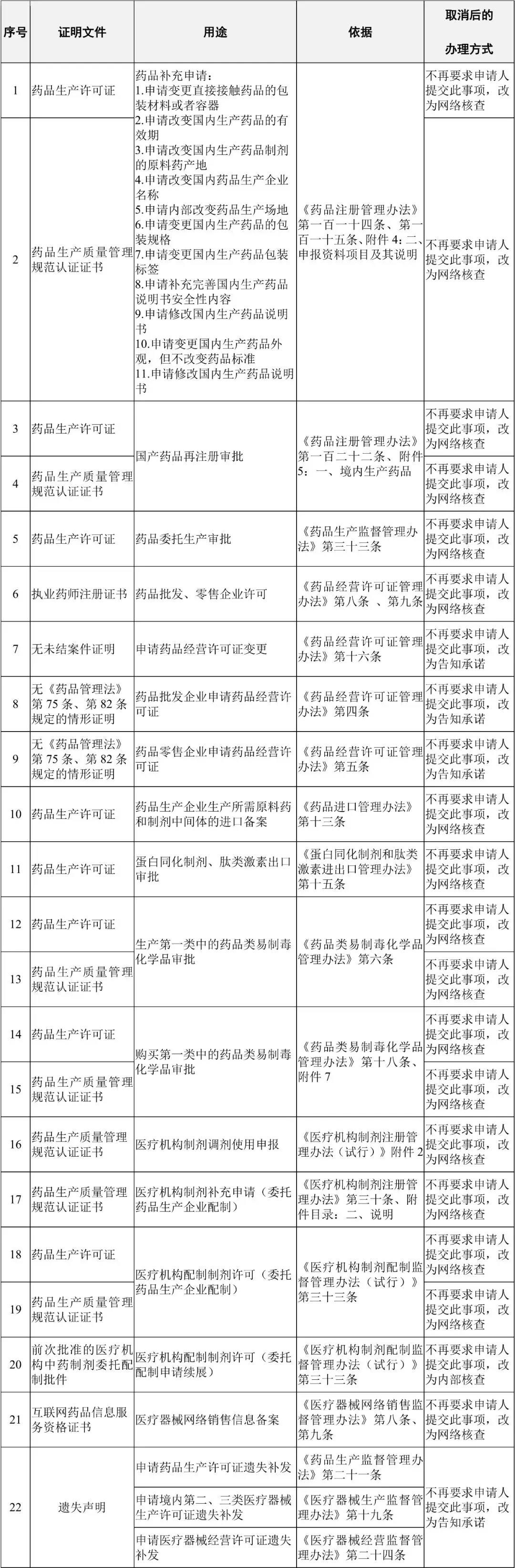
国家药监局:取消36项证明事项公告
今日,国家药监局发布《关于取消36项证明事项的公告》,根据公告,自发布之日起,停止执行14项由规范性文件所要求的证明事项,部门规章所要求的证明事项涉及修改部门规章的,按程序修改部门规章后,也将停止执行。
公告涉及事项包括:
涉及流程包括:
-
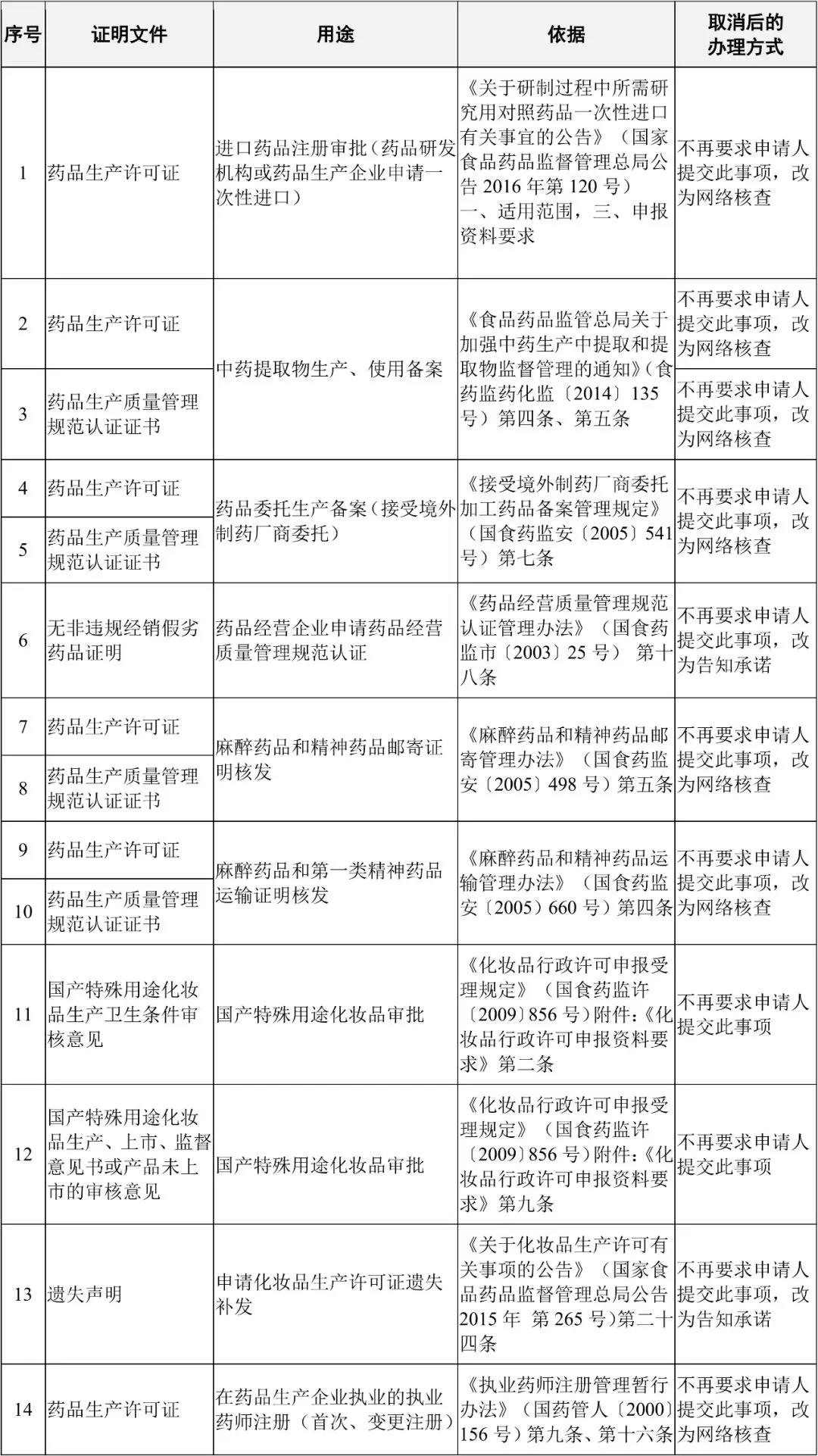
进口药品注册审批(药品研发机构或药品生产企业申请一次性进口)
-
中药提取物生产、使用备案
-
药品委托生产备案(接受境外制药厂商委托)
-
药品经营企业申请药品经营质量管理规范认证
-
麻醉药品和精神药品邮寄证明核发
-
麻醉药品和第一类精神药品运输证明核发
-
国产特殊用途化妆品审批
-
国产特殊用途化妆品审批
-
申请化妆品生产许可证遗失补发
-
在药品生产企业执业的执业药师注册(首次、变更注册)
-
药品补充申请:
1.申请变更直接接触药品的包装材料或者容器
2.申请改变国内生产药品的有效期
3.申请改变国内生产药品制剂的原料药产地
4.申请改变国内药品生产企业名称
5.申请内部改变药品生产场地
6.申请变更国内生产药品的包装规格
7.申请变更国内生产药品包装标签
8.申请补充完善国内生产药品说明书安全性内容
9.申请修改国内生产药品说明书
10.申请变更国内生产药品外观,但不改变药品标准
11.申请修改国内生产药品说明书
-
国产药品再注册审批
-
药品委托生产审批
-
药品批发、零售企业许可
-
申请药品经营许可证变更
-
药品批发企业申请药品经营许可证
-
药品零售企业申请药品经营许可证
-
药品生产企业生产所需原料药和制剂中间体的进口备案
-
蛋白同化制剂、肽类激素出口审批
-
生产第一类中的药品类易制毒化学品审批
-
购买第一类中的药品类易制毒化学品审批
-
医疗机构制剂调剂使用申报
-
医疗机构制剂补充申请(委托药品生产企业配制)
-
医疗机构配制制剂许可(委托药品生产企业配制)
-
医疗机构配制制剂许可(委托配制申请续展)
-
医疗器械网络销售信息备案
-
申请药品生产许可证遗失补发
-
申请境内第二、三类医疗器械生产许可证遗失补发
-
申请医疗器械经营许可证遗失补发

根据《国务院办公厅关于做好证明事项清理工作的通知》(国办发〔2018〕47号)要求,为进一步减证便民、优化服务,国家药品监督管理局决定取消36项证明事项(详见附件),现予以发布。自发布之日起,附件所列规范性文件设定的证明事项停止执行。附件所列部门规章设定的证明事项涉及修改部门规章的,按程序修改部门规章后再停止执行。
取消的部门规章设定的证明事项目录
取消的规范性文件设定的证明事项目录
特此公告。
国家药监局
2019年4月22日
联系方式
地址:中国(上海)自由贸易试验区 外高桥美约路222号五楼501室
邮 编:200131
传 真:58661522
电 话:58661516
邮 箱:mdta@mdta.org.cn
下载专区
相关链接
©2018 上海浦东医疗器械贸易行业协会
沪ICP备19039930号-1 沪公网安备31019002000210号 互联网药品信息服务资格证书编号:(沪)-非经营性-2022-0001
技术支持:维程教育




 loading......
loading......