视点 | 一文读懂“优先审评凭劵”的前世今生
一些传染病和寄生虫病,造成严重的医疗卫生负担。但由于这些疾病的患者,大多数经济状况不佳,因此,对这类疾病的治疗药物的研发投入,往往不尽如人意。从药品监管方面,如何通过对各方有利的制度设计,激励相关产品研发,破解这样的难题?
一些传染病和寄生虫病,造成严重的医疗卫生负担。但由于这些疾病的患者,大多数经济状况不佳,因此,对这类疾病的治疗药物的研发投入,往往不尽如人意。从药品监管方面,如何通过对各方有利的制度设计,激励相关产品研发,破解这样的难题?
优先审评凭券设想提出
在2006年公开发表于Health Affairs杂志上的一篇论文中,来自于杜克大学的David B. Ridley, Henry G. Grabowski和Jeffrey L. Moe博士,首次提出优先审评凭劵(priority review voucher,PRV)的设想。这篇论文建议,在批准相关新药申请的同时,可授予针对这类被忽视疾病治疗药物的开发者“优先审评凭券”。根据相关设想,优先审评凭劵,可为药品开发者审评节省时间。同时,优先审评凭劵可出让或出售给其它医药商,用于新药申请优先审评。在运作有序的市场中,借助优先审评凭劵,有望加速被忽视疾病的治疗药物研发。最终的目的,是使发展中国家和发达国家的消费者和纳税人,能够以较低的成本,从成功开发的药物获益。
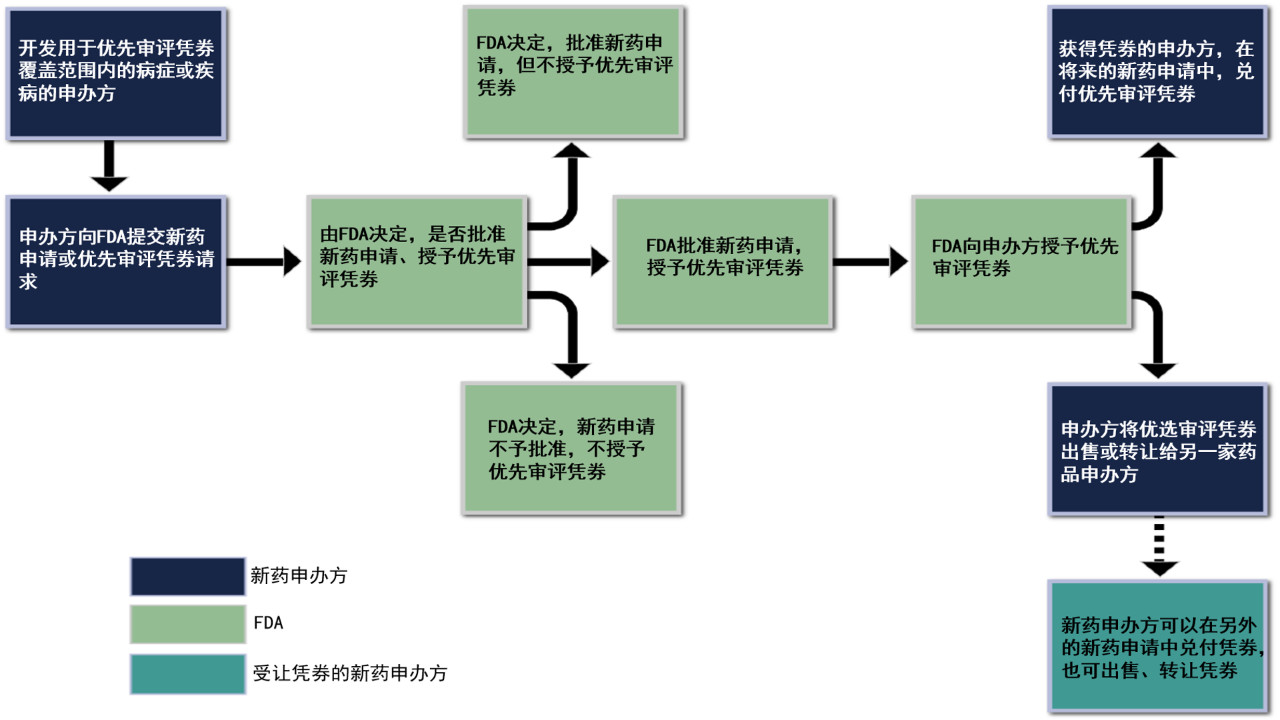
图片来源:参考资料[2]
在这篇文章发表之前,Ridley博士在多次会议上介绍过这一想法。这些会议,包括2004年6月的药品信息学会(DIA)会议,2005年1月的美国经济学会(American Economic Association,AEA)会议,2005年7月的国际卫生经济学学会(IHEA)会议。在Health Affairs上发表相关文章后不久,2006年3月7日,Ridley博士受邀,在全国记者俱乐部(National Press Club)介绍相关设想。在新闻发布会之后,《国会季刊》记者Laura Blinkhorn女士告诉Ridley博士,来自堪萨斯州的共和党参议员Sam Brownback会对这一想法感兴趣。随后,文章作者David Ridley和Jeff Moe博士拜会了Brownback参议员和随员。Brownback参议员随后提出《消除被忽视疾病修正案》提案,该修正案的主要思想,就来自于上述文章。来自俄亥俄州的民主党参议员Sherrod Brown和其他人士,加入了Brownback参议员提案支持者行列。
2008年,比尔-盖茨先生在达沃斯世界经济论坛演讲时表示,政府能够做的一些最高层次的杠杆化的工作,是以创造市场激励措施,来改善生活的方式制定政策和投入资金。根据时任总统布什在2007年签署的法律,开发疟疾或结核病等被忽视疾病新药的医药公司,都可以获得FDA对他们制造的另一种产品的优先审评。如果有公司正在开发一种新的疟疾治疗药品,那么这家公司有利可图的降胆固醇药物就有可能提前一年上市;这样的优先审评,可能带来价值数亿美元的获益,从而实现多赢。
相关立法
2007年FDA修正案法案规定了用于被忽视的热带病的优先审评凭劵计划。2012年FDA安全与创新法案,将优先审评凭劵计划扩展至儿童罕见病用药。依据2016年签署的《21世纪治愈法案》,将优先审评凭劵计划扩展至物质威胁医药对策。
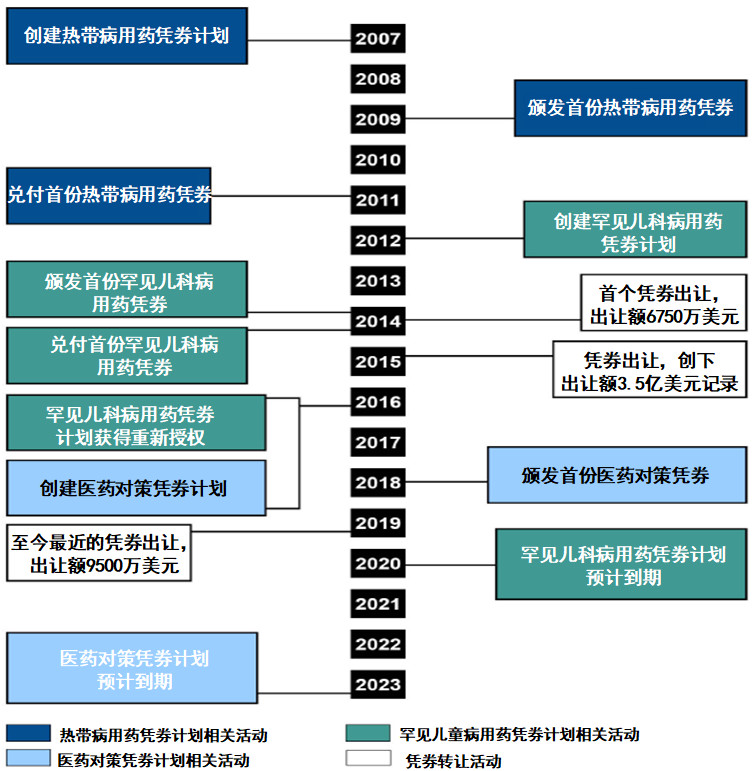
▲优先审评凭券计划的主要发展节点(图片来源:参考资料[2])
优先审评凭劵,可谓一石多鸟,在激励针对被忽视和罕见病的治疗药物开发的同时,加快潜在的重磅炸弹式药品的审批,让患者更快获得这些治疗药物。
药品获得优先审评,不可避免地占用审评资源,可能会减慢其它药品的审评速度。因此,在制度设计上,需要最大程度地避免上述情况地发生。为了向FDA提供更多资源并降低成本,依据相关法规,优先审评凭劵持有者,需要向FDA支付额外的费用(2018财年为280万美元,而2012财年时,高达500万美元)。FDA可以在每年一度的预算请求中,包含对兑付凭劵的预期。例如,如果FDA每年有4份兑付凭劵赎回,就可在预算请求中,要求额外的1000万美元。
优先审评凭劵可出让。例如,一家小公司,可能会获得开发用于被忽视疾病药物的优先审评凭劵,如果将其出售给大公司,由受让方用于具有商业前景的疾病治疗药品申请的审评。出让方的相关新药申请,以及受让方相关新药申请,都将在FDA获得优先审评资格。
优先审评凭劵制度的影响
FDA用于热带病的优先审评凭劵计划,使得不同的利益攸关方之间的开创性合作,成为可能。由于优先审评凭劵计划,投资者更愿意为开发被忽视疾病治疗药品的企业家提供资金。例如,NanoViricides公司开发在美国等市场具有巨大销售潜力的抗病毒药物,例如用于艾滋病和流感的药品。由于优先审评凭劵的激励,这家公司开始开发一种登革热治疗药物。NanoViricides公司首席执行官Eugene Seymour博士表示,在了解到优先审评凭劵计划后,这家公司开始推动用于治疗登革热/登革出血热药物的开发,相关药物,在FDA列出的优先审评凭劵资质类别中,属于病毒性疾病用药。该药物在NanoViricides公司的平台开发,已经完成最初的测试。Seymour博士表示,与多个机构进行了认真的讨论,其中包括美国疾控中心(CDC)的登革热部门负责人,对方承诺,给予临床试验支持;南美洲的一个大型基金会希望,相关新药在美国获批后,就药品销售展开讨论。如果没有优先审评凭劵计划,这些都无从发生。

图片来源:Pixabay
同样,全球卫生投资基金(Global Health Investment Fund)宣布向澳大利亚非营利性药品开发机构Medicines Development提供1千万美元,用于完成用于治疗河盲症的莫西他丁的注册。由于富裕国家并没有受到河盲症的影响,因此莫西他丁并未受到太多关注。但是,如果莫西他丁获批,那么就能够有助于加速根除河盲症。此外,如果相关药品获得FDA批准,并获得优先审评凭劵,该基金会将分享出让凭劵所得的部分回报,将相关的资金,投入全球卫生事业。该基金会首席执行官Mark Sullivan先生表示,该基金会能够吸引完成莫西他丁开发最后阶段所需的资金,是得益于优先审评凭劵价值体现的直接结果。如果没有这种机制,莫西他丁就错过了服务于全球健康的机会。
此外,总部位于西雅图的国际非营利卫生组织PATH在新闻稿中表示,该组织与政府、非营利组织和商业伙伴联合体一起,打算寻求FDA批准三苯双脒(TrBD)用于显著改善钩虫感染治疗。
优先审评凭劵资质
要符合优先审评凭劵资质的药品或疫苗必须符合以下标准。
1. 治疗以下疾病之一:
-
致盲性沙眼
-
布鲁里溃疡
-
美洲锥虫病(2015年由FDA增加)
-
奇昆古尼亚病毒病(Chikungunya virus disease)(2018年由FDA增加)
-
霍乱
-
隐球菌脑膜炎(Cryptococcal meningitis)(2018年由FDA增加)
-
登革热
-
麦地那丝虫病
-
肝片吸虫病
-
丝状病毒(包括埃博拉病毒)(2014年通过国会立法增加)
-
非洲人类锥虫病(河盲症)
-
拉沙热(2018年由FDA增加)
2. 不含任何其它FDA批准的任何申请中的活性成分(包括任何活性成分的酯或盐)。
3. 在治疗方面有重大进展,或在没有可用治疗药物的情况下,提供治疗手段,以其自身所体现出的优势,获得优先审评资质。
获得优先审评凭劵情况
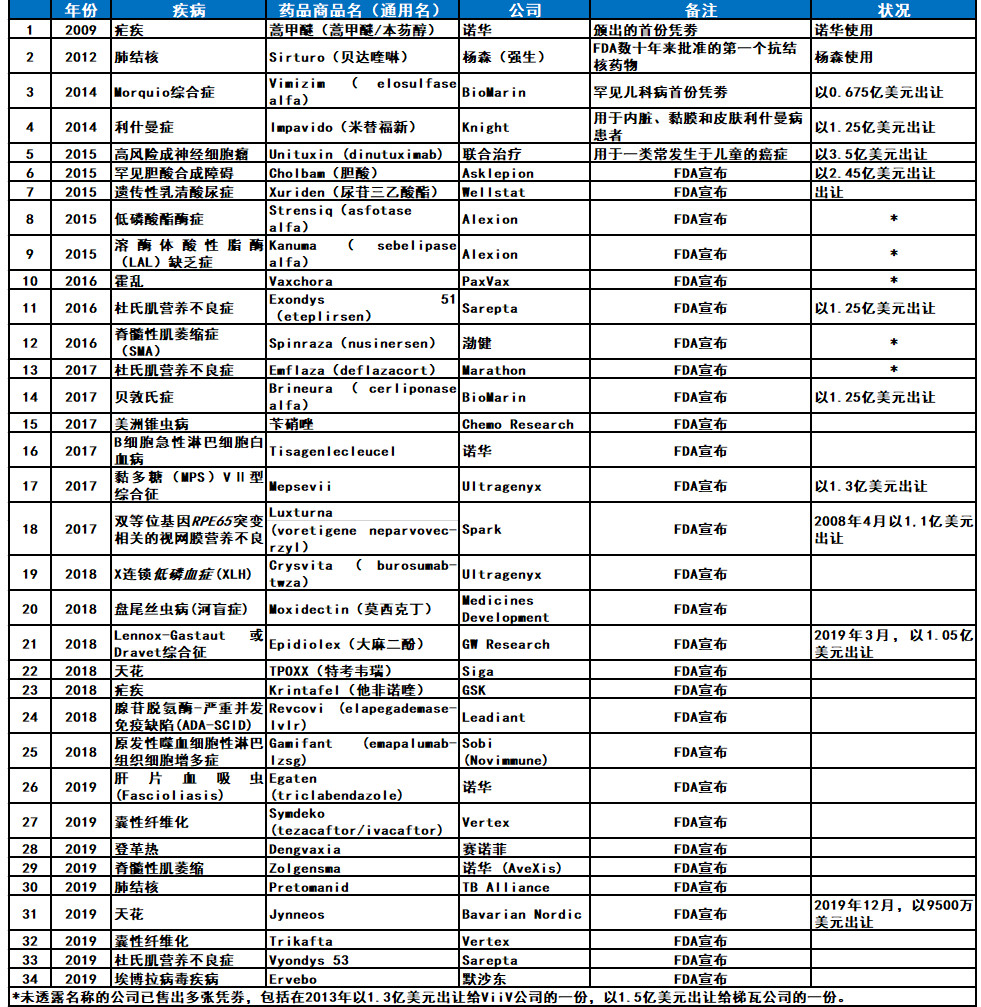
▲2009-2019年期间,获得优先审评凭劵的情况(数据来源:参考资料[23],药明康德内容团队制图)
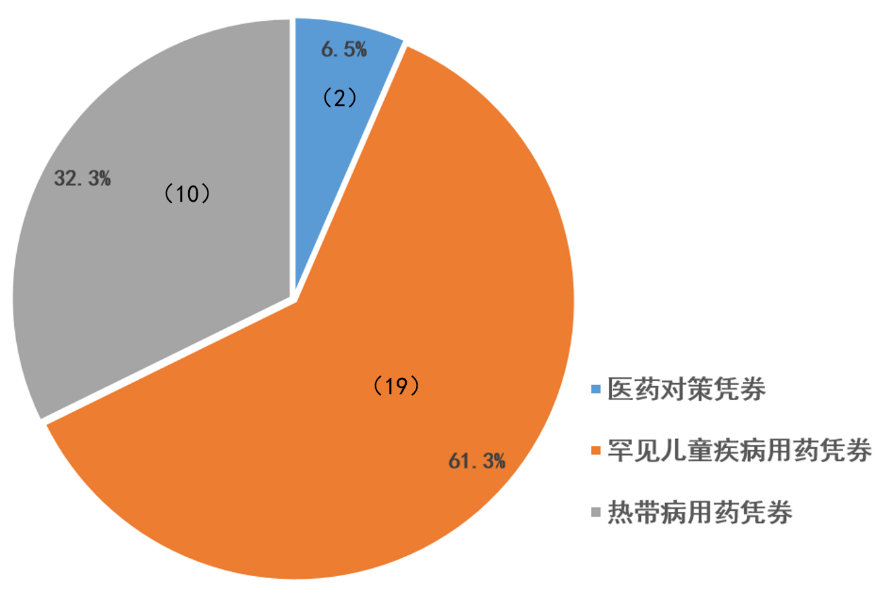
▲截至2019年9月30日,FDA授予优先审评凭券的情况(数据来源:参考资料[2],药明康德内容团队制图)
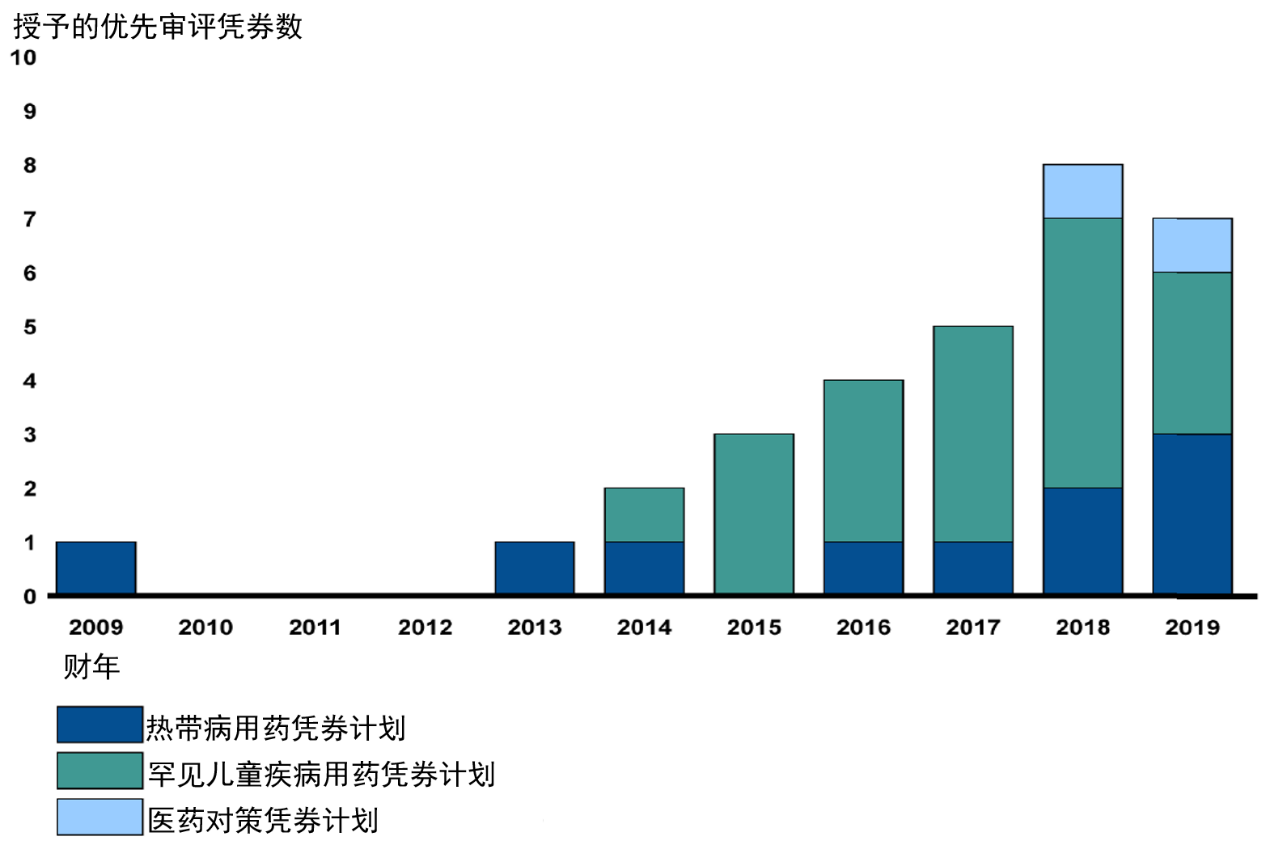
▲2009-2019财年,授予优先审评凭券情况(图片来源:参考资料[2])
出让价格随行就市
凭劵的出让额,取决于供应和需求。凭劵的价值,涉及到三个因素:之前的出让额,由于先发优势而延长的有效专利寿命,以及比竞争对手较早进入的竞争优势。凭劵的价值,还取决于药品的治疗领域。
首笔凭劵出让交易,发生在2014年。当时,赛诺菲/再生元公司以0.675亿美元的成交价受让凭劵。2015年,赛诺菲再次获得凭劵出让价格,上涨至3.5亿美元。
2015年,欧洲监管机构批准安进公司的胆固醇药物Repatha两个月之后,才批准赛诺菲/再生元公司的Praluent。而在美国,由于使用了优先审评凭劵,赛诺菲/再生元公司的Praocity比Repatha提前一个月获批。
下图为2008-2019年间,优先审评凭券出让金额的变化情况。今年2月17日,Vifor公司宣布,购入一份优先审评凭劵,但未披露转让方。
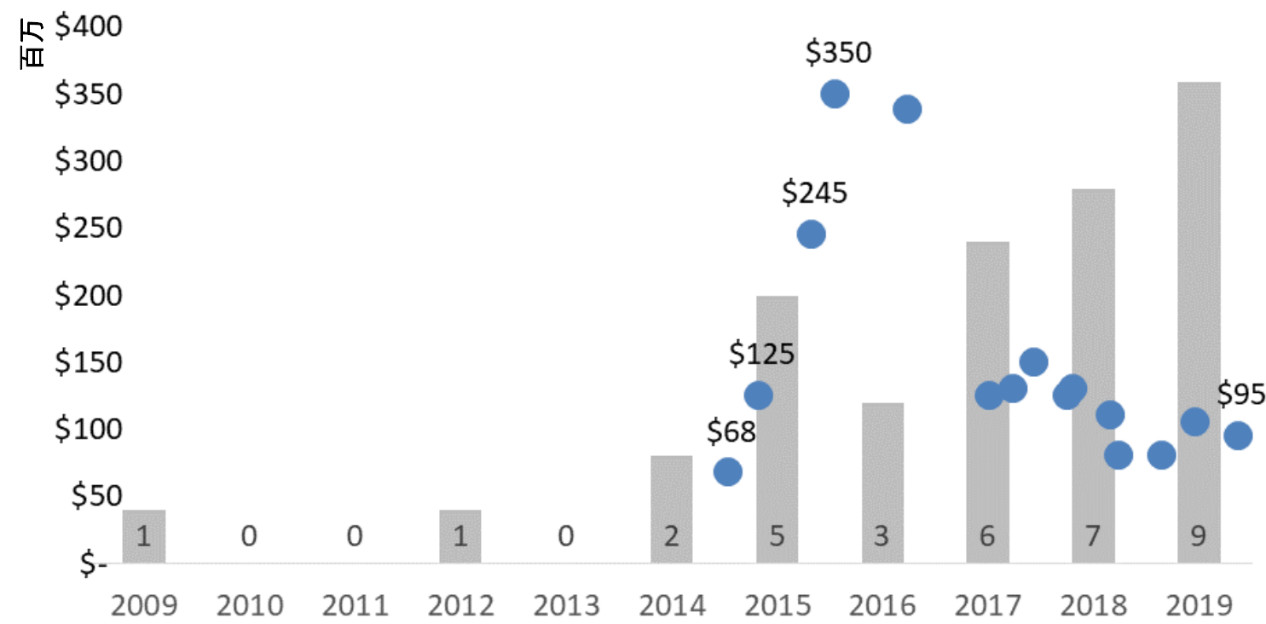
▲2009-2019年期间,优先审评凭劵出让情况(图片来源:参考资料[23])
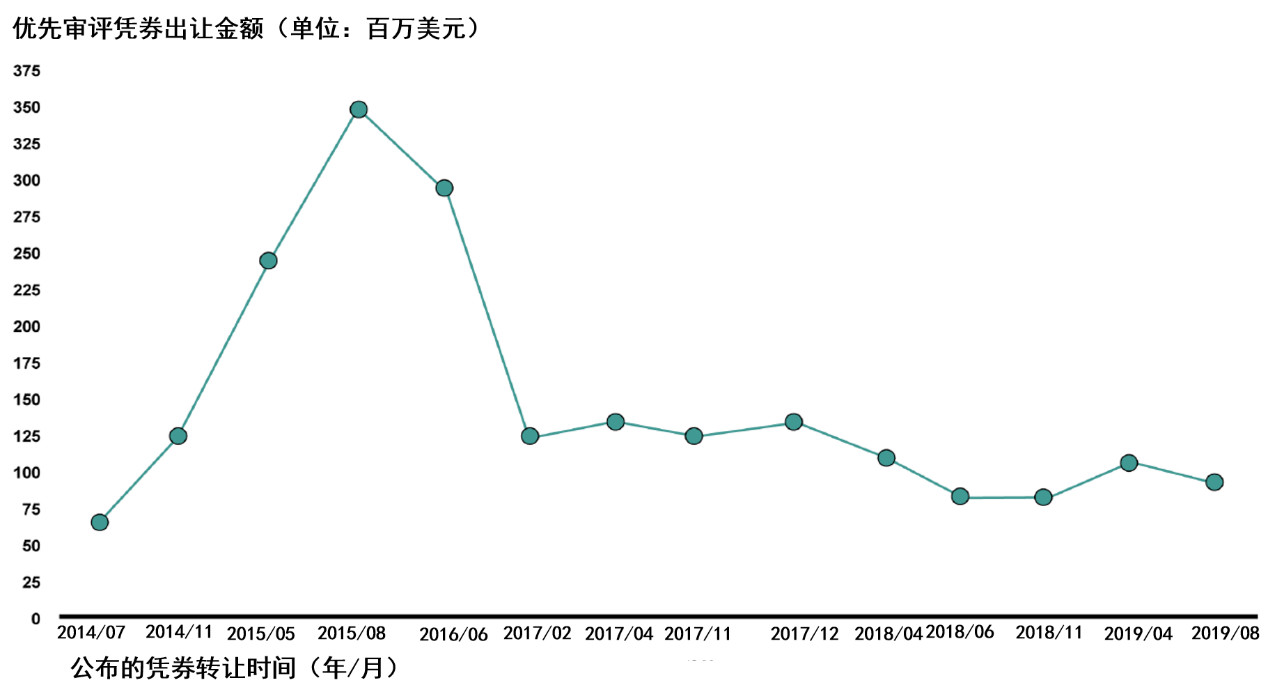
▲优先审评凭券出让金额变化情况(图片来源:参考资料[2])
优先审评凭劵有效期
依据相关法案规定,优先审评凭劵不会过期。此外,针对被忽视疾病的优先审评凭券计划(2007年制定),没有退出期限。然而,罕见儿科疾病计划将于2020年10月到期,但如果药品在2022年10月获得批准,那么认定为罕见儿科疾病治疗药品仍可获得凭券。罕见儿科疾病计划计划可展期,国会已多次将该计划展期。
优先审评凭劵制度的扩展
扩展至欧盟地区
在2010年发表于《柳叶刀》杂志的文章中,David Ridley博士等建议,将优先审评凭劵制度扩展到欧盟。这篇文章中提出的欧盟凭劵制度,将由欧洲药品管理局(EMA)提供优先注册审评,由欧盟成员国做出加速定价和报销决策。
专利延伸
受药品优先审评凭劵制度的启发,2012年,美国专利与商标办公室(USPTO)启动了一项名为“人道用途专利”的试点计划,鼓励企业申请用于应对人道挑战的专利技术。获得认定者,可请求将专利复审程序移到队列的前面;也可请求,将面对专利申诉和干涉委员会的专利申诉案,移至队列前;或加快专利的审查,以在12个月内对申请作出最终决定。适用的申请类别包括医疗技术、食品与营养、清洁技术和信息技术。2013年,USPTO颁发了10份加速证书。
扩展至罕见儿科疾病
2012年《FDA安全与创新法案》(FDASIA)第908条规定了罕见儿科疾病优先审评凭劵激励计划,将凭劵计划扩展至罕见儿科疾病。获得儿科用药PRV资质的药品或生物制品必须符合下述条件:不含有以前已被FDA批准的活性成分;有资质获得优先审评(除了奖励性的优先审评外);用于治疗罕见儿科疾病;依靠研究儿科人群和用于该人群的药品剂量研究的临床数据;不寻求罕见儿科疾病用药原始申请中的成人适应症批准。

▲用于热带病和罕见儿科疾病的优先审评凭劵计划对比(数据来源:参考资料[23],药明康德内容团队制图)
扩展至物质威胁医疗对策
依据相关立法,优先审评凭券计划,扩展至(化学、生物、放射、核)物质威胁医疗对策申请。
优先审评凭劵制度的局限
对于即便在没有该凭劵激励计划的情况下,也能够开发出相关药品的医药商,这种优先审评凭劵激励的方式,类似于慈善捐赠税收减免,即使在没有税收优惠的情况下,也可以实现。
优先审评凭劵计划,还奖励在全球其它地方已有上市的一些医药商。用于某些疾病的一些药品,在其它国家已经上市,但没有在美国注册,因此,相关药品可能有资质获得优先审评凭劵。对于在美国以外的地区上市已超过3年时间的药品,一些人士向国会呼吁,请求认定这些药品不符合凭劵资质。但这样的药品,在美国注册也具备一些优势,能够使得药品有资质获得保险支付,并能够向在部署时经常遭遇被忽视疾病的本国人士供应药品。
只是通过优先审评凭券激励,可能不足以解决实际困难。应对这些造成严重负担的疾病,可能需要更多的资源。哈佛大学发展经济学教授Michael Kremer及其同僚提出“前置市场承诺”(Advanced Market Commitments),呼吁为疟疾、肺结核和HIV/艾滋病等负担严重的被忽视疾病创造市场。
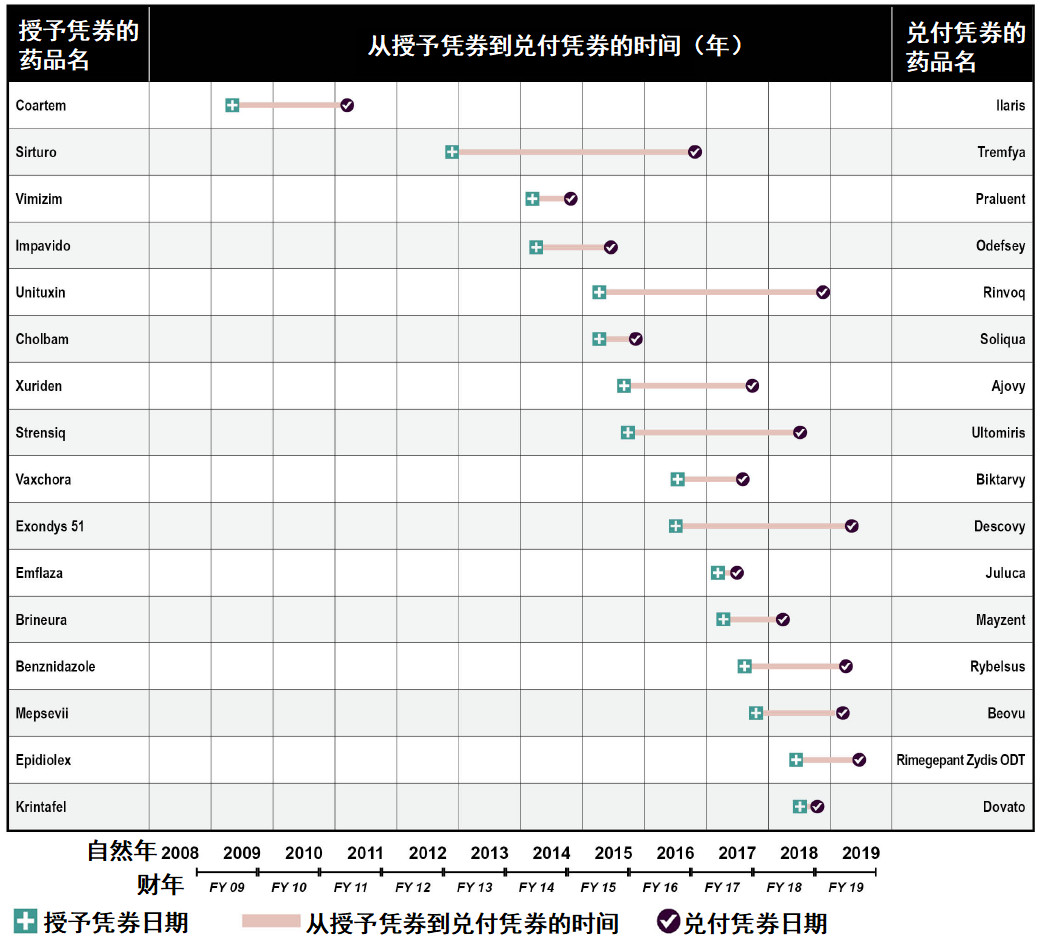
图片来源:参考资料[2]
现有激励措施,不能确保获得现有的治疗药物。一些开发者,例如全球健康药品开发组织(Medicines Development for Global Health),已经为这一组织开发的药品制定了计划。一些人士建议,所有的医药商都应该拥有这样的计划。如果没有这样的计划,可能需要政府或基金会的资金来采购用于贫困人口的治疗药品。
优先审评凭劵激励,有可能会占用FDA资源。因此,依据相关法律规定,医药商需要向FDA支付额外费用,并要求凭卷持有人,在使用凭卷前90天通知FDA。此外,有批评人士认为,这样的优先审评可能存在隐患。尽管优先评估并不意味着忽视安全性或有效性研究,但如果FDA受到压力,而加速赶上规定的为期6个月的优先审评期限,可能更容易犯错。
免责声明:本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。
参考资料:
1.David B. Ridley, Henry G. Grabowski, and Jeffrey L. Moe. Developing Drugs for Developing Countries. Health Affairs, 2006, 25(2): 313-324. doi.org/10.1377/hlthaff.25.2.313
2.GAO. DRUG DEVELOPMENT FDA’s Priority Review Voucher Programs. Jan 20, 2020. Retrieved Jan 21, 2020 from https://www.gao.gov/assets/710/704207.pdf
3. Aaron S. Kesselheim. Drug Development for Neglected Diseases: the Trouble with FDA Review Vouchers, New England Journal of Medicine, 2008, 359: 1981-1983. DOI: 10.1056/NEJMp0806684
4. Jeffrey L. Moe, David B. Ridley, and Henry G. Grabowski. FDA Review Vouchers. New England Journal of Medicine, 2009, 360: 837-838.
5. Henry G. Grabowski, David B. Ridley, and Jeff Moe. Priority Review Vouchers to Encourage Innovation for Neglected Diseases. Prescribing Cultures and Pharmaceutical Policy in the Asia-Pacific, 2009, K. Eggleston Brookings Institution Press.
6. Jason Matheny, Brad Smith, Brooke Courtney, and Michael Mair. Drug and Vaccine Development for Infectious Diseases: The Value of Priority Review Vouchers. Clinical Pharmacology & Therapeutics, 2009,85 (6): 571-572.
7. Aaron S. Kesselheim. Priority Review Vouchers: An Inefficient and Dangerous Way to Promote Neglected-Disease Drug Development. Clinical Pharmacology & Therapeutics, 2009, 85 (6): 573–575.
8. Waseem Noor. Placing Value on FDA's Priority Review Vouchers. InVivo, 2009, 27(8).
9. Jorn Sonderholm, In Defence of Priority Review Vouchers. Bioethics, 2009, 23(7): 413-420.
10. David B. Ridley and Alfonso Calles Sanchez. Introduction of European Priority Review Vouchers to Encourage Development of New Medicines for Neglected Diseases. The Lancet, 2010, 376(9744): 922-927.
11. Rianna Stefanakis, Andrew S. Robertson, Elizabeth L. Ponder, Melinda Moree. Analysis of Neglected Tropical Disease Drug and Vaccine Development Pipelines to Predict Issuance of FDA Priority Review Vouchers over the Next Decade. PLoS Neglected Tropical Diseases. 2009, 6(10): e1803.
12. Joshua S. Gans, David B. Ridley. Innovation Incentives under Transferable Fast-Track Regulatory Review. Journal of Industrial Economics,2013,61(3): 789-816.
13. David B. Ridley, Stephane A. Régnier. The Commercial Market for Priority Review Vouchers. Health Affairs, 2016,35(5): 776-783.14. David B. Ridley. Priorities for the Priority Review Voucher. The American Journal of Tropical Medicine and Hygiene, 2017. 96(1): 14–15.
15. Bavarian Nordic. Bavarian Nordic Announces the Sale of Priority Review Voucher. Dec 17, 2019. Retrieved Feb 12, 2020 from https://www.globenewswire.com/news-release/2019/12/17/1961822/0/en/Bavarian-Nordic-Announces-the-Sale-of-Priority-Review-Voucher.html
16. GW Pharmaceuticals plc. GW Pharmaceuticals plc Announces the Sale of Priority Review Voucher for $105M. Mar 18, 2019. Retrieved Feb 12, 2020 from https://www.globenewswire.com/news-release/2019/03/18/1756217/0/en/GW-Pharmaceuticals-plc-Announces-the-Sale-of-Priority-Review-Voucher-for-105M.html
17. FDA. 21st Century Cures Act: MCM-Related Cures Provisions. Oct 10, 2019. Retrieved Feb 12, 2020 from https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/21st-century-cures-act-mcm-related-cures-provisions
18. Ernst R. Berndt, Rachel Glennerster, Michael R. Kremer, et al. Advanced Market Commitments (AMCs) for Vaccines and Other Vaccines Research. Retrieved Feb 12, 2020 from https://scholar.harvard.edu/kremer/vaccine-research
19. 113th Congress. S.2917 - Adding Ebola to the FDA Priority Review Voucher Program Act. Dec 16, 2014. Retrieved Feb 12, 2020 from https://www.congress.gov/113/plaws/publ233/PLAW-113publ233.pdf
20. FDA. Office of the Commissioner. Office of the Chief Scientist. Office of Counterterrorism and Emerging Threats. Material Threat Medical Countermeasure Priority Review Vouchers. Guidance for Industry. DRAFT GUIDANCE. Jan,2018. Retrieved Feb 2, 2018 from https://www.fda.gov/media/110193/download
21. Waltz, E. FDA launches priority vouchers for neglected-disease drugs. Nat Biotechnol. 26, 1315–1316 (2008). https://doi.org/10.1038/nbt1208-1315
22. 114th Congress (2015-2016). H.R.34 - 21st Century Cures Act. Dec 13, 2016. Retrieved Dec 20, 2016 from https://www.congress.gov/bill/114th-congress/house-bill/34
23. David Ridley. Priority Review Vouchers. Retrieved Feb 12, 2020 from https://www.priorityreviewvoucher.org/
24. Businesswire. Vifor Pharma acquires Priority Review Voucher-. Feb 17, 2020. Retrieved Feb 18, 2020 from https://www.businesswire.com/news/home/20200216005042/en/Vifor
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
信息来源:医疗器械创新网
联系方式
地址:中国(上海)自由贸易试验区 外高桥美约路222号五楼501室
邮 编:200131
传 真:58661522
电 话:58661516
邮 箱:mdta@mdta.org.cn
下载专区
相关链接
©2018 上海浦东医疗器械贸易行业协会
沪ICP备19039930号-1 沪公网安备31019002000210号 互联网药品信息服务资格证书编号:(沪)-非经营性-2022-0001
技术支持:维程教育




 loading......
loading......