周末文摘 | 医疗器械唯一标识国内外进展
引用本文
易力,黄伦亮,余新华*.医疗器械唯一标识国内外进展[J].中国食品药品监管.2021.03(206):28-35.
医疗器械唯一标识国内外进展
Domestic and Global Progress of Unique Device Identification
易力
中国食品药品检定研究院
YI Li
National Institutes for Food and Drug Control
黄伦亮
国家药品监督管理局
HUANG Lun-liang
National Medical Products Administration
余新华*
中国食品药品检定研究院
YU Xin-hua
National Institutes for Food and Drug Control
Abstract
摘 要
Abstract
医疗器械唯一标识是当前全球医疗器械监管领域的热点,本文概括了唯一标识的国际进展和国家相关宏观政策,从我国唯一标识制度的建设和试点实施两方面介绍了我国唯一标识进展, 为各方了解唯一标识相关知识,积极实施和应用唯一标识提供参考和借鉴。
Unique Device Identification (UDI) is a hot topic in the field of global medical device regulation. This article summarizes the progress of UDI on the global scale and national policies associated with UDI, and introduces development of the UDI system in China and the pilot program for UDI implementation. The authors hope to provide relevant information to stakeholders and promote implementation of the UDI system.
Key words
关 键 词
Key words
医疗器械唯一标识;发码机构;标准;数据库
UDI; issuing agency; standard; database
2020 年10 月29 日, 党的十九届五中全会审议通过了《中共中央关于制定国民经济和社会发展第十四个五年规划和二〇三五年远景目标的建议》(以下简称《建议》),《建议》提出:要加快发展现代化产业体系,推动经济体系优化升级, 明确要提升产业链、供应链现代化水平,加快工业互联网、大数据中心等新型基础设施建设,推进数字产业化和产业数字化等。这些重大决策部署对医疗器械产业创新发展具有重要的指导意义,在“十四五”期间,医疗器械产业链、供应链数字化转型升级将成为重要的战略方向,作为重要基础之一的医疗器械唯一标识(unique device identifier,UDI), 将成为串联产业链、供应链、资金链、信用链的关键,逐渐引起各方的高度重视和认同并积极拓展基于UDI 的创新应用。2020 年9 月,国家药监局、国家卫生健康委、国家医保局联合印发《关于深入推进试点做好第一批实施医疗器械唯一标识的公告》,标志着UDI的实施进入“三医联动”共同推进的新时代。
2020 年12 月国务院常务会议审议通过《医疗器械监督管理条例》,增设了UDI 条款,明确了国家根据医疗器械产品类别,分步实施医疗器械唯一标识制度,实现医疗器械可追溯,为我国推行UDI 制度奠定了法规基础。
1 UDI 国际进展
UDI 是医疗器械全球监管的通用语言。国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF) 于2013 年12 月发布《UDI 指南》,为全球实施UDI 提供了一个共认的技术框架建议,有助于各方无差别地识别特定的医疗器械,拉开了全球实施UDI的序幕[1]。2017 年加拿大渥太华举办的IMDRF 第12 次管理委员会会议,通过了《UDI 应用指南》新项目提案,重开UDI 工作组,来自10 个成员国监管机构代表和部分业界代表参与了文件的起草工作, 并于2019 年发布《UDI应用指南》以及两份信息文件,分别为《在电子健康系统中记录UDI》和《UDI 数据元素在不同IMDRF 成员国的使用》,共同指导2013 年《UDI 指南》的实施。
2007 年《FDA 修正案》和2012 年《FDA 安全和创新法案》分别确立了美国实施UDI 系统的立法依据和实施时间表,2013 年9 月美国FDA 发布《UDI 最终规则》,计划通过7 年的时间分阶段逐步实施UDI。目前美国Ⅱ、Ⅲ类产品已经全部实施UDI[2]。由于政策的复杂性和新冠肺炎疫情的影响,为了确保数据质量,美国FDA 先后两次延迟了Ⅰ类产品的实施时间,根据目前最新的指南文件,2022 年9 月24 日前,美国FDA 不会要求I 类和未分类产品实施UDI[3]。
2017 年5 月,欧盟公报发布了医疗器械法规[REGULATION(EU)2017/745,简称“MDR”]和体外诊断试剂法规[REGULATION(EU)2017/746,简称“IVDR”],设置了UDI 专章,并规定了欧洲医疗器械数据库(European database onmedical devices, Eudamed)的相关建设内容。欧盟委员会原计划于2020 年5 月26 日对首批Ⅲ类医疗器械实施UDI,其他产品按照是否为IVD 产品和风险等级,分阶段逐步实施UDI。受新冠肺炎疫情影响,欧盟将MDR的生效时间延后一年至2021 年5 月26 日,第一批产品的实施时间相应修改为新的MDR 生效时间[4]。对于Eudamed,目前已经开放角色注册功能。
日本厚生劳动省自2002 年起,每年会对医疗器械等信息化进展情况进行调查,2008 年3月发布《关于对医疗器械等的条形码显示实施的通知》(医政经发第0328001 号),主要目的是提高物流和医保结算的效率。通知发布后3 年时间内按照风险等级逐步推进,并由医疗信息系统开发中心建立了数据库,登记与医疗器械条形码相关联的信息。根据2012 年厚生劳动省针对部分企业调研情况,99.1% 的医疗器械企业注册了GS1 条形码,97.6% 的产品标记到了最小销售单元,80% 的企业将数据上传至数据库[5]。日本以通知的形式提出了UDI 相关要求,主要是靠配送、销售和医保报销结算等后方推动。据悉,日本当局目前正准备对UDI 系统开展立法。
除以上国家或地区外,越来越多的国家或地区,如沙特、印度、韩国等也陆续发布了UDI 相关法规,今后几年将会是全球UDI 实施高峰期。
2 我国有关UDI 宏观政策
通过建立医疗器械唯一标识系统(Unique Device Identification System,UDI 系统),有利于运用信息化手段实现对医疗器械在生产、经营和使用各环节的快速、准确识别;有利于实现产品监管数据的共享和整合;有利于创新监管模式,提升监管效能;有利于加强医疗器械全生命周期管理。以下就近年来我国有关政策中UDI系统建设和追溯体系建设两方面分别介绍。
2.1 UDI 系统建设方面
早在2012 年,《国家药品安全“十二五”规划》提出启动高风险医疗器械国家统一编码工作,2017 年《“十三五”国家药品安全规划》明确提出制定医疗器械编码规则,构建医疗器械编码体系。2018、2019、2020 年深化医药卫生体制改革重点工作任务相关文件和2019 年《治理高值医用耗材改革方案》中也均有UDI相关要求,随着UDI 制度的不断推进,工作内容逐渐从制定法规到开展UDI 试点和实施,相关政策梳理见表1。

2.2 产品追溯方面
UDI 是医疗器械的“ 身份证”,其目的是医疗器械全生命周期的精准识别而非追溯,实现医疗器械的追溯需要相关方在各自的流程中使用和记录UDI,属于UDI 的应用层面。表2 梳理了近年来我国发布的关于产品追溯的相关文件,核心是通过信息化的手段,建立追溯体系,实现产品来源可查、去向可追、责任可究。2019 年《国务院关于加强和规范事中事后监管的指导意见》强调建立健全以产品编码管理为手段的追溯体系,进一步明确了标识是实现追溯的重要手段(UDI 系统仅包括标识、载体和静态数据库三部分,本身不具备追溯的功能, 追溯是UDI 的应用场景)。

3 我国UDI 制度建设
我国UDI 制度建设采用“法规 - 标准 - 数据库”三层体系,首先制订《医疗器械唯一标识系统规则》(以下简称《规则》),指导各方开展UDI 相关工作;再分别从UDI、数据载体和数据库方面制定标准、指南,开展编码标准化工作;根据UDI 应用需求,逐步开展医疗器械编码信息化建设。以下将从《规则》制定、相关标准制定、数据库建设和发码机构四个方面分别介绍。
3.1《 规则》制定
国家药品监管部门高度重视UDI 工作, 早在2013 年, 委托原国家食品药品监督管理总局医疗器械标准管理中心开展相关研究, 提出了我国以政府规范引导、企业主体实施的模式建立UDI 体系, 并于2014 年起草了《医疗器械编码规则(草案)》。2017 年,原国家食品药品监督管理总局召开UDI 工作会议,确定了医疗器械编码体系建设的总体思路。为更好地与国际接轨,符合医疗器械唯一标识作为医疗器械身份标识的内涵,避免与分类编码等称谓混淆,清晰各方认识,统一理解,经反复研究论证,将《医疗器械编码规则(征求意见稿)》修改为《医疗器械唯一标识系统规则(征求意见稿)》,分别于2018 年2 月和8 月在官网征求意见。2019 年8 月以国家药监局公告的形式发布。《规则》共18 条,主要包括总则、UDI、UDI 数据载体、UDI 数据库和附则5 部分[6]。
①总则部分明确了UDI 系统建设的目的、适用对象、适用范围、建设原则、监管部门和相关方职责。
② UDI 部分明确了UDI 的制定原则和组成结构,以及唯一标识创建的主体和对发码机构的要求。
③ UDI 数据载体部分规定了载体的形式、创建主体以及相关要求。
④ UDI 数据库部分规定了数据库责任主体和数据提交要求。
⑤附则部分包括相关术语的解释、鼓励各方应用以及实施时间的要求。
3.2 相关标准制定
根据国家药监局工作部署,UDI 技术标准制定的要求主要包括:研究国际医疗器械编码技术标准体系,充分考虑国际协调原则,结合我国行业编码的基础和现状,制定发布医疗器械编码基本要求和编码术语等相关基础通用标准。在已发布的信息化标准的基础上,制定发布医疗器械编码信息化系统数据收集、公开和交换规则和相关的接口等标准。目前国家药监局已发布《医疗器械唯一标识基本要求》等4 项UDI 医疗器械行业标准(表3),为《规则》提供技术保障,确保《规则》初期的顺利实施。
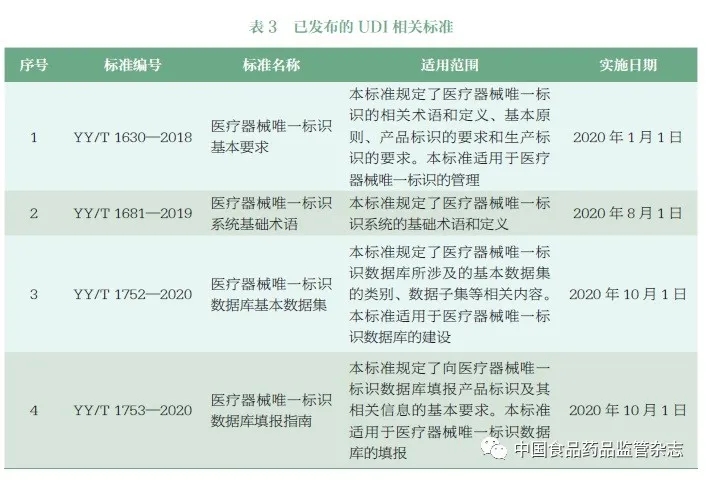
UDI 系统贯穿医疗器械注册、生产流通、使用全生命周期,涵盖标识、载体和数据库,涉及发码机构、信息技术机构和标准化机构等众多技术支撑机构。UDI系统标准体系跨行业、跨领域的内容多,建设难度大。例如,发码机构的标准是对医疗器械注册人/ 备案人实施UDI 系统的具体要求,也是我国UDI 系统标准体系的有机组成;UDI 载体标准已在各行各业被广泛使用和验证,并非仅局限于医疗器械行业。我国UDI 系统标准体系应当多方参与,发挥各方的特长优势,创建共赢的局面,同时也需要加强引导,规范行业行为。
3.3 UDI 数据库
UDI 数据库储存医疗器械的产品标识与相关信息,是UDI 制度的具体实施落地。2019 年12月,国家药监局医疗器械唯一标识数据库上线运行,向试点企业开放产品标识及相关数据申报功能。2020 年3 月31 日开放数据库共享功能,以查询、下载、接口对接等三种方式,供公众、医疗器械生产经营企业和医疗机构等各方查询使用。国家药监局网站的医疗器械唯一标识数据库中,包含UDI 相关政策法规、工作动态、研究应用等相关信息,开放了数据共享查询和供企业咨询的帮助台,并公布了系统操作指南、数据申报和数据对接说明、常见问题列表和发码机构及规则等信息,全方位指导各相关方有序开展UDI 数据申报共享工作。
3.4 发码机构
UDI 是医疗器械的“国际语言”,发码机构在UDI 制度建设中十分重要,目前实施UDI 的国家大多都采用多家发码机构[7-8](表4)。国际上,GS1、HIBCC和ICCBBA 被广泛使用, 除以上三家发码机构外,欧盟委员会还认可了德国的IFA。在我国,《规则》未要求认可发码机构,但提出了基本要求。发码机构应当为中国境内的法人机构,具备完善的管理制度和运行体系,并将其编码标准上传至UDI 数据库。目前在UDI 数据库中上传编码标准的发码机构有中国物品编码中心(GS1 中国)、中关村工信二维码技术研究院(ZIIOT)和阿里健康科技(中国)有限公司。
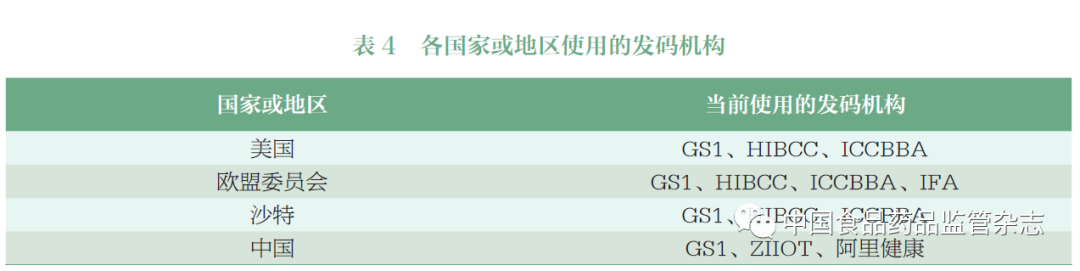
这种多码并行方式能避免市场垄断,有效降低转化成本,使企业可以根据自身需求选择最适合的编码类型,并且能够通过相关国际标准确保各编码的唯一性[9]。但如果发码机构过多或者医疗器械注册人/ 备案人未能严格按照发码机构的标准创建UDI,可能会导致各方无法正确识别和解析UDI相关信息。
4 UDI 试点和实施
2019 年7 月,国家药监局、国家卫生健康委联合印发《医疗器械唯一标识系统试点工作方案》,标志着我国UDI 的试点工作正式启动[10]。2019 年8 月, 国家药监局发布《规则》,旨在规范UDI 系统建设,加强医疗器械全生命周期管理,《规则》于2019年10 月1 日起正式施行,基于产品风险程度分步实施。2019 年10 月12 日,国家药监局发布《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》(2019年第72 号),对第一批实施UDI的品种范围、进度安排、工作要求等进行了明确规定,纳入首批实施范围的九大类64 个品种于2020 年10 月1 日起开始实施。受新冠肺炎疫情影响,UDI 试点深度尚有不足,2020年9月29日,国家药监局联合国家卫生健康委、国家医保局发布《关于深入推进试点做好第一批实施医疗器械唯一标识的公告》,延长了试点时间,并增加了第一批国家高值医用重点治理清单中的产品,首批九大类69个品种已经于2021 年1 月1 日起实施UDI。
4.1 UDI 试点开展情况
16 个省( 区、市) 卫生健康委和药监局、108 家医疗机构、116 家医疗器械生产经营企业参与了UDI 试点工作。为进一步加强UDI 系统试点工作的组织领导和统筹协调,确保试点工作顺利开展,国家药监局联合国家卫生健康委成立医疗器械唯一标识系统试点工作部门协作工作小组(以下简称协作小组),作为试点工作议事协调机构,主要负责组织UDI 系统试点工作,协调解决试点工作中的重大问题,指导协调各单位开展UDI 系统试点工作。协作小组下设4 个专业工作组,包括综合管理组、临床应用组、技术标准组和信息化组。
截至目前,国家药监局联合国家卫生健康委、国家医保局,在各相关方共同努力下,已基本建立健全UDI 法规标准体系,搭建UDI 数据平台,实现UDI 创建、赋予以及数据上传下载和共享功能;积极推动UDI 系统试点的“三医联动”模式,UDI 在医疗器械生产、经营、使用等全生命周期各环节得到示范应用,有力助推了医疗器械从生产到临床使用全链条联动。截止到2020 年12 月下旬,企业共享数据约33 万条,涉及21 大类医疗器械。从器械品种数据看,无源植入器械2.5 万条,神经和心血管手术器械3.2万条,眼科器械1.6 万条;从各省(市)提交的数据来看,上海、天津、山东、北京、江苏等地区企业提交的数据位居前列。2020年11 月,国家医保局组织集中采购的10 个冠脉支架产品,均赋有UDI 并上报数据库。
4.2 三医联动和两码衔接应用
试点期间,药监、卫健、医保三部门已建立了共同推进UDI工作的良好协作工作机制。在国家药监局督促指导下, 试点省(区、市)药监局因地制宜积极推动UDI 试点工作。例如,福建省药监局形成医药、医疗和医保“三医联动”推进的工作机制,为试点工作的开展提供有效的组织保障;上海市药监局探索覆盖医疗器械全生命周期UDI 试点;天津市药监局积极探索UDI 在卫健、医保等领域的衔接应用,助推“三医联动”。2021 年, 更多的省(区,市)加入到“三医”联合推动UDI 实施中来,积极探索辖区内全域试点,扩大试点品种范围,提升参与广度和深度,拓展UDI的衔接应用。相关经验将为下一步深化合作,推动医保分类代码、UDI 等编码的衔接,探索在高值耗材采购、上市后监管、临床结算等管理场景中的应用打下坚实的基础。
UDI 作为医疗器械的“身份证”,贯穿产品全生命周期,同时UDI 也是“物码”,需要附在医疗器械的包装上,是串联物流和信息流的有效工具,能和其他分类代码相关联,从而通过扫码的形式获取所需信息,提高效率,UDI 数据库库中也设置了医保医用耗材分类与代码字段。2019 年6 月,国家医保局发布《国家医疗保障局关于印发医疗保障标准化工作指导意见的通知》(医保发〔2019〕39 号),公布了医保疾病诊断和手术操作、药品、医疗服务项目、医用耗材四项信息业务编码规则和方法,其中医保医用耗材分类与代码借鉴相关单位现行耗材编码方法,根据专家共识,对医疗服务项目中可单独收费的一次性医用耗材,形成了统一分类与代码,共包含血管介入治疗材料、口腔材料、眼科材料等17 大类。在国家医保局医药耗材分类与代码数据库中,设置有外包装条码字段,对应该产品包装对应的UDI-DI,如果将药监部门UDI 数据库和医药耗材分类与代码数据库打通,实现两码衔接应用(部分省试点文件称其为“两码映射”),一方面能够提高企业申报的效率和准确度,另一方面能够让医院在日常扫码业务流程中关联医保代码信息,更好地满足结算的需求。
4.3 下一步实施的关注点
试点工作为各相关方探索UDI 的实施和应用提供了一个良好的平台,通过试点充分验证了制度的可行性和可操作性,但也暴露出一些难点,需要在下一步实施中予以关注:①产业发展不平均,部分地区对UDI 制度的了解还有所缺乏,需要进一步宣贯。② UDI 制度采取分步实施的方式,今后一段时间并非所有的器械都有UDI,导致院内码和UDI 码并存的现象[11],需要医院合理考虑编码转化的过渡期。③部分医院提出高于法规的要求,例如使用单元赋码和序列号化管理[12],建议企业加强沟通并根据器械的类型和客户需求选取适当的实施方式。④ 考虑到器械的多样性, 部分复杂的器械, 如组合包类医疗器械、可配置医疗器械系统、IVD 等, 需要更详细的实施指导。
5 结语
UDI 作为在医疗器械全生命周期中关联物流和信息流的工具,其重要性已被越来越多的国家所认识,全球UDI 实施步伐不断迈进。UDI 制度是一个系统性工程,需要各方积极参与,其他国家或地区通常仅由医疗器械监管部门单方面实施,各环节缺乏有效地沟通,对医疗器械使用和结算环节的需求考虑不充分,暴露出一系列的问题[13]。我国发挥制度优势,采用“三医联动”的方式协同推进试点和实施,取得了很好的效果。在此基础上,部分产业发达地区先试先行,积极在辖区内探索全域试点,为今后全面实施提供了宝贵的经验。目前我国UDI 实施位于国际前列,只有所有相关方(从生产企业到医疗机构和患者)都在他们的工作流程系统中使用UDI,才能将实施UDI 的利益最大化[14],在逐步推行UDI 制度的同时需要考虑和各环节的衔接应用,从而更好地发挥UDI 的作用,提高监管效能,保证人民群众用械安全。
第一作者简介
易力,中国食品药品检定研究院医疗器械标准管理研究所,助理研究员。专业方向:UDI 相关基础通用标准制定和医疗器械编码技术研究
通讯作者简介
余新华,中国食品药品检定研究院医疗器械标准管理研究所所长,编审。专业方向:医疗器械标准体系研究,医疗器械分类、命名、编码研究
信息来源:中国食品药品监管杂志
联系方式
地址:中国(上海)自由贸易试验区 外高桥美约路222号五楼501室
邮 编:200131
传 真:58661522
电 话:58661516
邮 箱:mdta@mdta.org.cn
下载专区
相关链接
©2018 上海浦东医疗器械贸易行业协会
沪ICP备19039930号-1 沪公网安备31019002000210号 互联网药品信息服务资格证书编号:(沪)-非经营性-2022-0001
技术支持:维程教育




 loading......
loading......