全球医疗器械UDI编码标准首推GS1标准
由于GS1的使用范围和领域更加广泛,已在众多行业成熟应用40年,得到了生产企业的广泛支持。从国际整体发展来看,全球医疗器械UDI编码标准首推GS1标准。
随着国民经济快速增长,人民生活水平逐步提高,我国卫生事业取得了显著成就,覆盖城乡的医药卫生服务体系基本形成,医疗保障覆盖人口逐步扩大,卫生科技水平也在提高。同时,伴随国家相关政策的逐步出台,医疗行业势必会在蓬勃发展的同时更趋规范,药品流通业和医药电子商务也会有更广阔的发展空间。但我国医疗信息化发展还处于过渡阶段,由于历史和经济等各方面原因,中国的医药供应链发展还存在问题,与发达国家相比还存在较大差异。
我国医药产业的管理体制与运作模式自成体系,相对封闭,总体表现为:传统供应链模式已不能满足市场需求,供应链中信息交互格式、编码结构、产品信息描述的标准化问题愈显突出,造成了供应链环节增多、物流速度减慢、物流费用增加、信息交换不畅通、信息冗余、医疗成本增加等,在医疗行业中假冒伪劣产品、医疗事故屡屡发生,人为介入致使供应链效率低下,医疗事故中责任追溯困难,问题产品召回不畅等现象存在。
由于医疗器械行业涉及到医药、机械、电子等多个行业,品种繁多、监管复杂等特点给政府、医院、企业的内部管理造成了困难。目前,国际上已有很多国家使用统一标准对医疗器械进行监管。我国在借鉴国际先进经验的基础上,政府监管部门也在制定相关政策。
UDI的出现
为了实现医疗器械的全供应链追踪追溯、辅助监管、保证患者安全,国际上提出了UDI(唯一器械标识)的概念,旨在为医疗器械的有效识别提供一个全球统一的方案。组成UDI系统的三个关键因素是:UDI编码、UDI载体、UDI数据库。UDI编码由两部分组成,器械标识和生产标识。UDI载体通过使用自动识别技术实现UDI的快速读取。UDI数据库用来存放产品的相关信息,是UDI系统的核心。UDI系统实现了编码结构标准化、信息交换格式标准化和产品信息描述、传输标准化。
2011年,国际医疗器械监管机构论坛(IMDRF,前身为GHTF)正式成立。该组织由美国、欧盟、加拿大、澳大利亚和日本在内的5个成员国家和地区发起。2013年,食品药品监督管理总局代表我国加入IMDRF。为形成全球协调一致的医疗器械唯一身份标识,便于对医疗器械在全球进行监管,指导各国建立UDI系统,IMDRF特成立UDI工作组(UDIWG),并于2013年对GHTF的《医疗器械唯一标识(UDI)系统》指导草案进行了修订,提出了《医疗器械UDI系统》指导性最终文件。文件指出推荐全球采用标准化的编码标识系统来实施UDI。欧洲医疗器械行业协会(Eucomed)在此框架下进一步制定了《基于风险管理的不同包装级别医疗器械UDI标识要求》;2013年9月,美国FDA明确提出医疗器械必须要有UDI标识,且分阶段实施,到2020年9月,美国FDA要求所有医疗器械生产企业都要对其生产的产品进行UDI标识,并将相关产品数据上报到UDI数据库。与此同时,欧盟也正在研究制订相关立法。
基于GS1标准的UDI
从国际整体发展来看,全球医疗器械UDI编码标准首推GS1标准,同时也允许使用HIBC和ICCBBA标识体系。由于GS1的使用范围和领域更加广泛,已在众多行业成熟应用40年,得到了生产企业的广泛支持,目前,已有许多企业将应用于医疗器械产品上的HIBC转换为GS1标准,如强生和波士顿科学等医疗器械生产企业。
为进一步推广全球医疗行业GS1标准的应用与技术研究,GS1成立了全球医疗保健大会(GS1 Healthcare),该组织成员来自全球各地的政府部门、医院、医药制造公司、医疗器械生产商、协会、分销中心等。主要目标是研究、发展全球统一编码,以帮助提升患者安全和医疗供应链操作效率,并对全球统一编码标准如何在医疗领域中进行应用给出建议。该组织每年召开2次会议,吸引各国医疗领域专家到场。
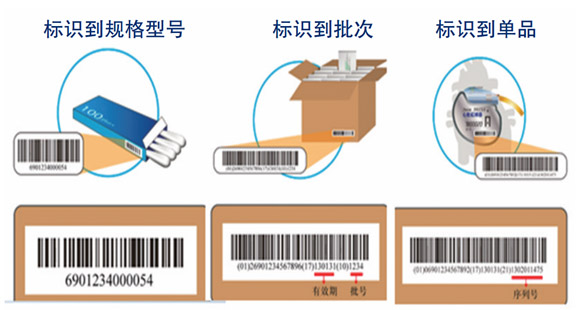
目前已有32个国家、地区的编码组织在各自管辖区内成立本国家、地区的医疗用户组,负责推动GS1标准在本国或本地区的实施,以提升医疗供应链管理效率。 GS1作为全球广泛使用的编码标准体系,已被150多个国家和地区的超过200万家企业所采用,广泛应用于包括医疗保健在内的众多领域,极大提高了全球供应链效率。在IMDRF制订的《医疗器械UDI系统》指导性最终文件中提出推荐采用基于GS1标准体系的UDI。此外,以欧洲医疗器械行业协会提出的《基于风险管理的不同包装级别医疗器械UDI标识要求》等文件为导则,在GS1技术规范指导下制定的GS1标准能够满足医疗器械监管追溯的不同层次需求,实现追溯至品规、批次、单品的目标。
在2008年,日本厚生省卫生部编制了《医疗器械标识代码放置指南》推进GS1编码与条码标识标准的实施,目前医疗器械GS1条码覆盖率已超过98%;2013年12月,美国FDA授予GS1编码组织为首个UDI编码发证机构;英国卫生部于2014年5月发布《NHS电子采购战略(NHS eProcurement Strategy)》,提出在实施电子采购过程中采用GS1标准。
此外,德国、法国、澳大利亚、印度、土耳其等60多个国家和地区都推荐采用GS1标准对药品、医疗器械等医疗产品进行标识。
我国UDI实施情况
作为统一组织、协调、管理我国商品条码、物品编码与自动识别技术的专门机构,中国物品编码中心(以下简称编码中心)一直高度重视医疗领域编码标准技术的应用与推广,于2008年专门成立了医疗保健领域推广工作组,进一步在我国推广国际通用的GS1编码标识系统,即商品条码系统。几年来,编码中心密切跟踪国际先进技术的应用发展,积极参与国际编码标准化工作;深入研究国内药监卫生行业监督及信息化建设的方针政策,紧密联系药监、卫生、商务部门及相关组织机构,分析医疗信息化现状与需求,积极宣传推广、提供编码与自动识别技术标准化解决方案;在医药移动POS系统、医药仓储管理与物流配送、医药商品条码信息服务、植入性医疗器械在医院的监管追溯等方面做了积极有益的尝试。特别是在2013年,组织制定了《基于GS1标准的唯一器械标识(UDI)编制规范》,为我国医疗器械主管部门的UDI政策制定及编码技术研究提供了有益参考,受到了国内外有关领导和专家的高度认可。基于GS1标准的植入性医疗器械追溯系统已在我国上海等150多家医院得到了应用,实现对植入医疗器械的单品追溯,在取得良好的社会效益的同时,节省了大量医疗供应链操作成本,保证了患者安全,改善了医患关系。
随着全球网络信息技术的迅猛发展以及我国医疗器械行业国际化进程的加快,相信在不久的将来,以商品条码为核心的GS1标准体系在我国医疗器械行业乃至全球医疗健康产业中必将得到更加广泛的应用。
联系方式
地址:中国(上海)自由贸易试验区 外高桥美约路222号五楼501室
邮 编:200131
传 真:58661522
电 话:58661516
邮 箱:mdta@mdta.org.cn
下载专区
相关链接
©2018 上海浦东医疗器械贸易行业协会
沪ICP备19039930号-1 沪公网安备31019002000210号 互联网药品信息服务资格证书编号:(沪)-非经营性-2022-0001
技术支持:维程教育




 loading......
loading......